题目内容
下列离子方程式书写正确的是( )
| A、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、盐酸与澄清石灰水反应:H++OH-═H2O |
| C、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、二氧化碳通入足量的氢氧化钠溶液:CO2+OH-═HCO3- |
考点:离子方程式的书写
专题:
分析:A.铁与稀硫酸反应生成硫酸亚铁,不会生成铁离子;
B.澄清石灰水中,氢氧化钙需要拆开,反应实质为氢离子与氢氧根离子反应生成水;
C.醋酸为弱酸,离子方程式中醋酸不能拆开,需要保留分子式;
D.氢氧化钠溶液足量,二氧化碳与氢氧化钠溶液反应生成碳酸根离子和水.
B.澄清石灰水中,氢氧化钙需要拆开,反应实质为氢离子与氢氧根离子反应生成水;
C.醋酸为弱酸,离子方程式中醋酸不能拆开,需要保留分子式;
D.氢氧化钠溶液足量,二氧化碳与氢氧化钠溶液反应生成碳酸根离子和水.
解答:
解:A.铁跟稀硫酸反应生成硫酸亚铁和氢气,正确的离子方程式巍峨:Fe+2H+═Fe2++H2↑,故A错误;
B.盐酸与澄清石灰水反应反应生成氯化钙和水,反应的离子方程式为:H++OH-═H2O,故B正确;
C.碳酸钙与醋酸反应生成醋酸钙、二氧化碳和水,醋酸和碳酸钙都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故C错误;
D.二氧化碳通入足量的氢氧化钠溶液,反应生成碳酸钠和水,反应的离子方程式为:CO2+2OH-═H2O+CO32-,故D错误;
故选B.
B.盐酸与澄清石灰水反应反应生成氯化钙和水,反应的离子方程式为:H++OH-═H2O,故B正确;
C.碳酸钙与醋酸反应生成醋酸钙、二氧化碳和水,醋酸和碳酸钙都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故C错误;
D.二氧化碳通入足量的氢氧化钠溶液,反应生成碳酸钠和水,反应的离子方程式为:CO2+2OH-═H2O+CO32-,故D错误;
故选B.
点评:本题考查了离子方程式的正误判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应方程式相同的是( )
| A、Na和O2 |
| B、NaOH和CO2 |
| C、Na2O2和CO2 |
| D、木炭(C)和O2 |
固定容积为2L的密闭容器中发生反应xA(g)+yB(g)?zC(g),图Ⅰ表示200℃时容器中各物质的量随时间的变化关系,图Ⅱ表示平衡时平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( )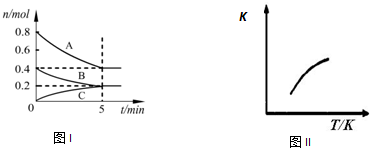

| A、200℃时,反应从开始到平衡的平均速率v(A)=0.08 mol?L-1?min-1 |
| B、若0~5 min时容器与外界的热交换总量为m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol |
| C、200℃时,若在第6 min再向体系中加入催化剂,可使v正>v逆 |
| D、200℃时,平衡后再充入2 mol C,则达到平衡时,化学平衡常数变小 |
下列各项中的两种物质无论以何种比例混合,只要混合物的总物质的量一定.则完全燃烧时生成水的质量和消耗O2的质量均不变的是( )
| A、C3H6、C3H8O |
| B、C3H6、C2H6O |
| C、C2H2、C6H6 |
| D、CH4、C2H4O2 |
配制一定物质的量浓度的NaOH溶液时,可造成所配溶液浓度偏高的是( )
| A、所用NaOH已吸潮 |
| B、摇匀后液面低于刻度线,不再补加水 |
| C、有少量NaOH溶液残留在烧杯内 |
| D、向容量瓶加水至时刻度线时俯视液面 |
已知常温下,AgBr的Ksp=4.9×10-13 mol2?L-2、AgI的Ksp=8.3×10-17 mol2?L-2 下列说法正确的是( )
| A、在常温下AgI水溶液中,Ag+和I-浓度的乘积是一个常数 |
| B、在常温下,在任何含AgI固体的溶液中,c(Ag+)=c(I-)且Ag+与I-浓度的乘积等于8.3×10-17 mol2?L-2 |
| C、常温下,将1mL 1.0×10-2 mol/L的KI与AgNO3溶液等体积混合,则生成AgI沉淀所需AgNO3溶液的最小浓度为3.32×10-14mol/L |
| D、向AgI饱和溶液中加入AgBr固体,c(I-)不变,Ksp值不变 |
下列溶液中各微粒的浓度关系正确的是( )
| A、pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,NH4+大小顺序为①>②>③ |
| B、pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)] |
| C、0.2 mol?L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| D、0.2 mol?L-1 HCl与0.1 mol?L-1 NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |