题目内容
9.T℃时,在容积为2L的3个恒容密闭容器中发生反应:3A(g)+B(g)?xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molA、2molB | 6molA、4molB | 2molC |
| 达到平衡的时间/min | 5 | 8 | |
| A的浓度/mol•L-1 | C1 | C2 | |
| C的体积分数/% | ω1 | ω3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 若 x<4,2C1<C2 | |
| B. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短 | |
| C. | 无论x的值是多少,均有2ρ1=ρ2 | |
| D. | 若 x=4,则ω1=ω3 |
分析 A.恒温恒容下,乙等效为在甲中平衡基础上压强增大一倍,若x<4,则正反应为气体体积减小的反应,平衡正向移动,则乙中反应物转化率高于A中反应物转化率;
B.起始浓度越大,反应速率越快,则到达平衡时间越短;
C.起始乙中同种物质的投入量是甲的2倍,根据质量守恒定律知,乙中气体质量为甲中2倍,容器的容积相等;
D.若x=4,反应前后气体的体积不变,开始只投入C与起始投料比n(A):n(B)=3:1为等效平衡,平衡时同种物质的含量相等,甲中起始投料比为3:2,等效为在起始投料比n(A):n(B)=3:1的基础上再加入1份的B,平衡正向移动,平衡正向移动,B的转化率降低,B的含量增大,A的含量减低,C的含量不能确定.
解答 解:A.恒温恒容下,乙等效为在甲中平衡基础上压强增大一倍,若x<4,则正反应为气体体积减小的反应,平衡正向移动,则乙中反应物转化率高于A中反应物转化率,则2C1>C2,故A错误;
B.乙中起始浓度越大,反应速率越快,到达平衡时间更短,所以容器甲达到平衡所需的时间比容器乙达到平衡所需的时间长,故B错误;
C.起始乙中同种物质的投入量是甲的2倍,根据质量守恒定律知,乙中气体质量为甲中2倍,容器的容积相等,则一定存在2ρ1=ρ2,故C正确;
D.若x=4,反应前后气体的体积不变,开始只投入C与起始投料比n(A):n(B)=3:1为等效平衡,平衡时同种物质的含量相等,甲中起始投料比为3:2,等效为在起始投料比n(A):n(B)=3:1的基础上再加入1份的B,平衡正向移动,B的转化率降低,B的含量增大,A的含量减低,C的含量不能确定,故D错误;
故选C.
点评 本题考查化学平衡的计算,题目难度中等,涉及等效平衡的判断、化学平衡及其影响化学反应速率、转化率等知识,注意判断等效平衡为解答关键,注意掌握化学平衡及其影响,试题培养了学生的分析能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | 正反应是放热反应的可逆反应,升高温度v(正)>v(逆) | |
| B. | 加压可使速率加快,是因为增加活化分子百分数而使反应速率加快 | |
| C. | 活化分子的碰撞不一定都能发生化学反应 | |
| D. | 催化剂可改变反应进程,故加催化剂改变了一个反应的△H |
| A. | 1mol | B. | 3mol | C. | 4mol | D. | 6mol |
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.发生的化学反应是2NH3(g)+NO(g)+NO2(g)═2N2(g)+3H2O(g)△H<0.
①当该反应有l mol N2(g)生成时,电子转移总数是3NA或1.806×1023.
②为了加快反应反应速率,并且提高的转化率,采取的措施是a(填字母).
a.增大NH3的浓度 b.增大N2的浓度 c.增大压强 d.选择合适的催化剂
(2)消除氮氧化物的另一种方法是用甲烷催化还原氮氧化物,己知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol
②N2(g)+2O2(g)=2NO2(g)△H=-67.0kJ/mol
①则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-823.3kJ/mol
②在3.0L密闭容器中,通入0.10mol CH4和0.20mol NO2,在一定温度进行反应,反应时间表(t)与容器内气体总压强(p)的数据如表:
| 时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
(3)利用ClO2消除氮氧化物的污染,反应过程如下:(部分反应物或生成物略去)
N2$→_{反应I}^{ClO_{2}}$NO2$→_{反应Ⅱ}^{Na_{2}SO_{3}溶液}$NO
反应I的产物中还有两种强酸生成,且其中一种强酸硝酸与NO2的物质的量相等,若有11.2L N2生成(标准状况),共消耗ClO267.5g.
| A. | 钢铁制品的腐蚀常以析氢腐蚀为主 | |
| B. | 厨房中常用碳酸钠溶液洗涤餐具上的油污 | |
| C. | 明矾[KAl(SO4)2•12H2O]用于水的杀菌消毒 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 |
| 实验序号 | H2C2O4溶液 | KMnO4溶液 | 温度 |
| Ⅰ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅱ | 20mL 0.1mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅲ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 50℃ |
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该反应过程中发生的实验现象溶液紫色变浅(或溶液紫色褪去),有无色气泡产生.
(2)实验Ⅰ、Ⅲ(填实验序号)探究的是温度对化学反应速率的影响.
(3)若用如图一进行该实验.
①在实验过程中装药品前必须进行的实验操作检查装置气密性(填操作名称).若反应相同时间,则针筒中所得CO2的体积由大到小的顺序是Ⅲ>Ⅰ>Ⅱ(填实验序号).
②若实验Ⅰ在2min末收集了4.48mL CO2(气体体积已换算为标准状况下),则在2min末,c(MnO4-)=0.0052mol•L-1.
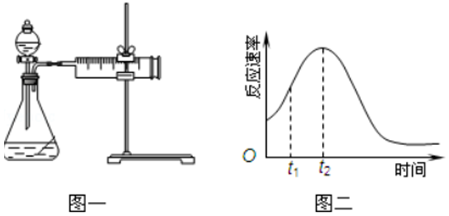
(4)该实验小组同学发现KMnO4和H2C2O4(草酸)反应的反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热;②产物Mn2+(或MnSO4)是反应的催化剂.


 N2O4(g)已达平衡状态,因反应是放热反应,放置时气体温度下降,平衡向正反应方向移动,NO2浓度降低.[已知2NO2(g)?N2O4(g)在几微秒内即可达到化学平衡].
N2O4(g)已达平衡状态,因反应是放热反应,放置时气体温度下降,平衡向正反应方向移动,NO2浓度降低.[已知2NO2(g)?N2O4(g)在几微秒内即可达到化学平衡]. 郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动.
郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动. .
.