题目内容
19.一实验小组用酸性KMnO4和H2C2O4(草酸,水溶液为无色的二元弱酸)反应研究影响反应速率的因素,其欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):| 实验序号 | H2C2O4溶液 | KMnO4溶液 | 温度 |
| Ⅰ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅱ | 20mL 0.1mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅲ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 50℃ |
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该反应过程中发生的实验现象溶液紫色变浅(或溶液紫色褪去),有无色气泡产生.
(2)实验Ⅰ、Ⅲ(填实验序号)探究的是温度对化学反应速率的影响.
(3)若用如图一进行该实验.
①在实验过程中装药品前必须进行的实验操作检查装置气密性(填操作名称).若反应相同时间,则针筒中所得CO2的体积由大到小的顺序是Ⅲ>Ⅰ>Ⅱ(填实验序号).
②若实验Ⅰ在2min末收集了4.48mL CO2(气体体积已换算为标准状况下),则在2min末,c(MnO4-)=0.0052mol•L-1.
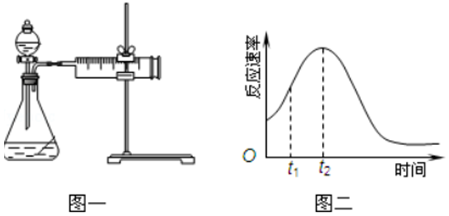
(4)该实验小组同学发现KMnO4和H2C2O4(草酸)反应的反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热;②产物Mn2+(或MnSO4)是反应的催化剂.
分析 (1)KMnO4和H2C2O4发生氧化还原反应生成锰离子、二氧化碳、水,根据得失电子守恒、电荷守恒配平离子方程式;高锰酸根为紫色,二价锰离子无色;
(2)对比Ⅰ、Ⅲ实验温度不同,其他条件相同;
(3)①该实验要收集气体,实验前必须检查气密性;反应速率越快,相同时间内收集到的二氧化碳越多;
②先求出反应的n(MnO4-)的物质的量,再求出反应后的浓度;
(4)根据反应过程中反应物浓度在减小,要加快反应的条件还可能是温度和催化剂的作用.
解答 解:(1)KMnO4和H2C2O4发生氧化还原反应生成锰离子、二氧化碳、水,KMnO4和中锰降低了5价,1个H2C2O4分子中有2个+3价的C,所以升高1×2=2价,根据化合价升降总数相等可以确定KMnO4和H2C2O4的比例关系为:2:5,再根据电荷守恒配平离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;反应现象为溶液紫色变浅(或溶液紫色褪去),有无色气泡产生,
故答案为:2;5H2C2O4;6H+;2;10;8;溶液紫色变浅(或溶液紫色褪去),有无色气泡产生;
(2)对比Ⅰ、Ⅲ实验可知温度不同,高锰酸钾溶液的浓度相同,草酸浓度也相同,则两个实验是探究温度对化学反应速率的影响,
故答案为:Ⅰ、Ⅲ;
(3)①该实验要收集气体,实验前必须检查气密性;Ⅱ中草酸的浓度比Ⅰ大,Ⅱ的化学反应速率大于Ⅰ,Ⅲ的温度最高,温度每升高10℃,反应速率增大2到4倍,所以Ⅲ的反应速率大于Ⅰ和Ⅱ,反应速率越快,相同时间内收集到的二氧化碳越多,则相同时间内所得CO2的体积由大到小的顺序是Ⅲ>Ⅰ>Ⅱ,
故答案为:检查装置气密性;Ⅲ>Ⅰ>Ⅱ;
②CO2的物质的量是:4.48×10-3L÷22.4L/mol=0.0002mol,设2min末,消耗n(MnO4-)为x
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 10
x 0.0002mol
解得x=0.00004mol
余下的n(MnO4-)=30×10-3L×0.01mol•L-1-0.00004mol=0.00026mol
则2min中末c(MnO4-)=$\frac{n}{V}$=$\frac{0.00026mol}{0.05L}$=0.0052mol/L
故答案为:0.0052;
(4)研究发现反应速率总是如图二所示发生变化,则t1~t2时间内速率变快的主要原因可能是:
①该反应为放热反应,反应放出的热量使环境温度升高,加快了反应速率,
②产物Mn2+(或MnSO4)是反应的催化剂,
故答案为:产物Mn2+(或MnSO4)是反应的催化剂.
点评 本题考查了影响化学反应速率的因素,注意掌握影响化学反应速率的因素,明确探究影响化学反应速率因素的方法,难度中等.

| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molA、2molB | 6molA、4molB | 2molC |
| 达到平衡的时间/min | 5 | 8 | |
| A的浓度/mol•L-1 | C1 | C2 | |
| C的体积分数/% | ω1 | ω3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 若 x<4,2C1<C2 | |
| B. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短 | |
| C. | 无论x的值是多少,均有2ρ1=ρ2 | |
| D. | 若 x=4,则ω1=ω3 |
| A. | 用托盘天平称量25.21 g氯化钠 | B. | 用10 mL量筒量取7.50 mL稀硫酸 | ||
| C. | 用25 mL滴定管量取14.86 mL溶液 | D. | 用广泛pH试纸测得溶液的pH为4.2 |
| A. | FeCl3 | B. | Fe2O3 | C. | Fe(OH)3 | D. | Fe3O4 |
 对于反应2A(g)+B(g)?2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定:
对于反应2A(g)+B(g)?2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定: