题目内容
14. 郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动.
郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动.(1)附属小学同学在科学课堂上做了如下两个探究实验:
①用如图装置探究硫与纯氧的反应,实验中产生了明亮的蓝紫色火焰,该反应的化学方程式为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2.
②常温下,将2mol/L的AgNO3溶液与0.5mol/L的Na2S溶液等体积混合,生成了黑色沉淀,计算此时溶液中硫离子浓度[S2-]=2.52×10-49mol/L. (已知常温下Ksp[Ag2S]=6.3×10-50)
(2)桐柏校区初中部同学在化学课上学到,硫元素在化合物中通常显-2价,但李华发现某教辅中出现了 Na2S2这种物质,认为可能是教辅印刷错误;赵老师告知李华,不但有Na2S2,还有Na2S3,Na2Sx等多种物质.
①已知化合物Na2S3中,各原子(或离子)最外层均达到8电子稳定结构,则Na2S3的电子式为
 .
.②多硫化钠Na2Sx (x≥2)在碱性溶液中可被NaClO氧化为Na2SO4,反应中Na2Sx 与NaClO的物质的量之比为1:16,则x=5.
(3)龙湖校区化学研究小组同学探究溶液中离子浓度的计算:已知常温下,某亚硫酸氢钠溶液pH=6,则该溶液中SO32-与H2SO3浓度的差值[SO32-]-[H2SO3]=10-6-10-8mol/L.(填准确值)
(4)桐柏校区同学查阅资料后发现:
①硫元素和氧元素能形成多种酸根离子,其中有一种离子能与盐酸发生氧化还原反应,该反应常用于反应速率的测定实验中,则该反应的离子方程式为S2O32-+2H+=S↓+SO2↑+H2O.
②硫酸的第二步电离是不完全的,则Na2SO4溶液显碱性.(填“酸”、“中”或“碱”)
(5)中原校区同学设计实验,利用双层膜法电解亚硫酸钠溶液得到硫酸和氢氧化钠,则 电解时的阳极反应方程式为SO32--2e-+H2O=SO42-+2H+.
分析 (1)①硫在氧气中燃烧生成二氧化硫;
②将2mol/L的AgNO3溶液与0.5mol/L的Na2S溶液等体积混合,AgNO3过量,根据反应后溶液中银离子浓度结合Ksp[Ag2S]计算;
(2)①硫原子之间形成一个共用电子对,硫离子与钠离子之间以离子键结合;
②Na2Sx 失电子,NaClO得电子,根据得失电子守恒计算;
(3)已知常温下,某亚硫酸氢钠溶液pH=6,溶液显酸性,溶液中存在电荷守恒和物料守恒,据此计算得到;
(4)①硫元素和氧元素能形成多种酸根离子,其中有一种离子能与盐酸发生氧化还原反应是硫代硫酸根离子和酸反应生成二氧化硫、硫单质和水;
②硫酸的第二步电离是不完全的,则Na2SO4溶液中硫酸根离子水解生成硫酸氢根离子,促进水的电离平衡正向进行溶液显碱性;
(5)利用双层膜法电解亚硫酸钠溶液得到硫酸和氢氧化钠,则 电解时的阳极反应是亚硫酸根离子失电子发生氧化反应生成硫酸根离子.
解答 解:(1)①硫在氧气中燃烧生成二氧化硫,反应的化学方程式为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,故答案为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;
②将2mol/L的AgNO3溶液与0.5mol/L的Na2S溶液等体积混合,AgNO3过量,设溶液体积为1L,则反应2Ag++S2-=Ag2S↓后溶液中银离子浓度c(Ag+)=0.5mol/L,常温下Ksp[Ag2S]=c2(Ag+)c(S2-)=6.3×10-50,c(S2-)=$\frac{6.3×1{0}^{-50}}{0.5mol/L}$=2.52×10-49mol/L,
故答案为:2.52×10-49mol/L;
(2)①化合物Na2S3中,各原子(或离子)最外层均达到8电子稳定结构,硫原子间分别形成一对共用电子对,和钠离子键形成离子键,电子式为 ,故答案为:
,故答案为: ;
;
②多硫化钠Na2Sx (x≥2)在碱性溶液中可被NaClO氧化为Na2SO4,氯元素化合价+1价变化为-1价,ClO-~Cl-~2e-,硫元素化合价变化为:Na2Sx~xSO42-~(6x+2)e-,反应中Na2Sx 与NaClO的物质的量之比为1:16,电子守恒得到16×2=1×(6x+2),
x=5,
故答案为:5;
(3)某亚硫酸氢钠溶液pH=6,溶液中存在电荷守恒:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),物料守恒:c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),则该溶液中SO32-与H2SO3浓度的差值[SO32-]-[H2SO3]=c(H+)-c(OH-)=(10-6-10-8)mol/L,
故答案为:10-6-10-8;
(4)①硫元素和氧元素能形成多种酸根离子,其中有一种离子能与盐酸发生氧化还原反应是硫代硫酸根离子和酸反应生成二氧化硫、硫单质和水,反应的离子方程式为:S2O32-+2H+=S↓+SO2↑+H2O,故答案为:S2O32-+2H+=S↓+SO2↑+H2O;
②硫酸的第二步电离是不完全的,电离方程式H2SO4=H++HSO4-,HSO4-?H++SO42-,则Na2SO4溶液中硫酸根离子水解生成硫酸氢根离子,促进水的电离平衡正向进行溶液显碱性,故答案为:碱性;
(5)电解亚硫酸钠溶液得到硫酸和氢氧化钠,则 电解时的阳极反应是亚硫酸根离子失电子发生氧化反应生成硫酸根离子,阳极反应方程式为:SO32--2e-+H2O=SO42-+2H+,
故答案为:SO32--2e-+H2O=SO42-+2H+.
点评 本题考查了溶度积常数计算、电解质溶液中电荷守恒、物料守恒的分析、氧化还原反应电子守恒的计算、电解池原理等知识点,掌握基础是解题关键,题目难度中等.

| A. | 我国目前使用的主要能源是化石能源 | |
| B. | 氢能源的优点有:热量值高、对环境友好 | |
| C. | 核能发电是解决能源危机的最佳途径 | |
| D. | 太阳能的缺点有:能量密度低、稳定性差 |
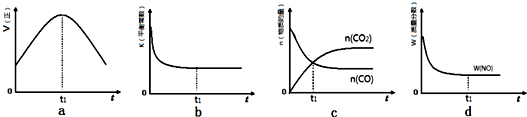
(1)治理尾气中NO和CO的一种方法是:在汽车排气管上装一个催化转化装置,使二者发生反应转化成无毒无污染气体,该反应的化学方程式是2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
(2)活性炭也可用于处理汽车尾气中的NO.在1L恒容密闭容器中加入0.1000mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如下表:
| 活性炭/mol | NO/mol | A/mol | B/mol | p/MPa | |
| 200℃ | 2.00 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.050 | 0.0250 | 0.0250 | p |
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液.常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Kal(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=4.2×10-9.
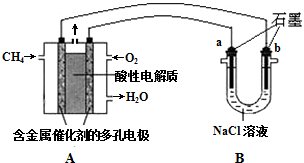
(4)尾气中的碳氢化合物含有甲烷,其在排气管的催化转化器中可发生如下反应CH4(g)+H20(1)?CO(g)+3H2 (g)△H=+250.1kJ•mol-l.已知CO(g)、H2(g)的燃烧热依次为283.0kJ•mol-1、285.8kJmol-1,请写出表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol.以CH4(g)为燃料可以设计甲烷燃料电池,该电池以稀H2S04作电解质溶液,其负极电极反应式为CH4-8e-+2H2O=CO2+8H+,已知该电池的能量转换效率为86.4%,则该电池的比能量为13.4kW•h•kg-1(结果保留1位小数,比能量=$\frac{电池输出电能(kW•h)}{燃料质量(kg)}$,lkW•h=3.6×1 06J).
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molA、2molB | 6molA、4molB | 2molC |
| 达到平衡的时间/min | 5 | 8 | |
| A的浓度/mol•L-1 | C1 | C2 | |
| C的体积分数/% | ω1 | ω3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 若 x<4,2C1<C2 | |
| B. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短 | |
| C. | 无论x的值是多少,均有2ρ1=ρ2 | |
| D. | 若 x=4,则ω1=ω3 |
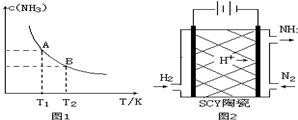
①当温度由T1变化到T2时,平衡常数关系K1>K2(填“>”,“<”或“=”),焓变△H<0.(填“>”或“<”)
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为8.00×10-3mol/(L•min).
③T1温度下该反应的化学平衡常数K1=18.3.
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S>0(填“>”或“<”).
若已知:N2(g)+3H2(g)=2NH3(g)△H=a kJ/mol
2H2(g)+O2(g)=2H2O(l)△H=b kJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H=(2a-3b)kJ/mol(用含a、b的式子表示).
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图2所示,则阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)已知某些弱电解质在水中的电离平衡常数(25℃)如表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
①该溶液呈性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液呈碱性.
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是B.
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)