题目内容
1.据统计,2015年入冬以来,华北黄淮地区己经出现4次严重雾霾过程,持续时间达37天.氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法.(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.发生的化学反应是2NH3(g)+NO(g)+NO2(g)═2N2(g)+3H2O(g)△H<0.
①当该反应有l mol N2(g)生成时,电子转移总数是3NA或1.806×1023.
②为了加快反应反应速率,并且提高的转化率,采取的措施是a(填字母).
a.增大NH3的浓度 b.增大N2的浓度 c.增大压强 d.选择合适的催化剂
(2)消除氮氧化物的另一种方法是用甲烷催化还原氮氧化物,己知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol
②N2(g)+2O2(g)=2NO2(g)△H=-67.0kJ/mol
①则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-823.3kJ/mol
②在3.0L密闭容器中,通入0.10mol CH4和0.20mol NO2,在一定温度进行反应,反应时间表(t)与容器内气体总压强(p)的数据如表:
| 时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 总压强p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
(3)利用ClO2消除氮氧化物的污染,反应过程如下:(部分反应物或生成物略去)
N2$→_{反应I}^{ClO_{2}}$NO2$→_{反应Ⅱ}^{Na_{2}SO_{3}溶液}$NO
反应I的产物中还有两种强酸生成,且其中一种强酸硝酸与NO2的物质的量相等,若有11.2L N2生成(标准状况),共消耗ClO267.5g.
分析 (1)①氧化还原反应中,化合价升高的数值=化合价降低数值=转移电子数;
②化学反应是2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O是气体计量数增大的反应,提高NOx的转化率,平衡正向移动,由此分析解答;
(2)①根据盖斯定律CH4(g)将NO2(g)还原为N2(g)等的热化学方程式;
②8min时处于平衡状态,压强之比等于物质的量之比,则平衡时混合气体总物质的量为(0.1+0.2)mol×$\frac{6}{4.8}$=0.375mol,再利用三段式计算平衡时各组分的物质的量,根据K=$\frac{c(C{O}_{2})•c({N}_{2})•{c}^{2}({H}_{2}O)}{c(C{H}_{4})•{c}^{2}(N{O}_{2})}$计算平衡常数;
(3)根据信息知道一氧化氮和二氧化氯之间反应生成产物是硝酸、盐酸以及二氧化氮,根据化学方程式结合电子守恒来计算.
解答 解:(1)根据化合价升高的数值=化合价降低数值=转移电子数,化合价升高情况:NH3~3e-~N2,所以当有1mol N2(g)生成,该反应的电子转移的量是3mol,总数是3NA或1.806×1023,
故答案为:3NA或1.806×1023;
②化学反应是2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O是气体计量数增大的反应,提高NOx的转化率,平衡正向移动,
a.增大NH3的浓度,反应速率加快,平衡正向移动,故a正确;
b.增大N2的浓度,平衡逆向,NOx的转化率减小,故b错误;
c.增大压强,平衡逆向移动,故c错误;
d.选择合适的催化剂,平衡不移动,故d错误;
故答案为:a;
(2)①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol,
②N2(g)+2O2(g)=2NO2(g)△H=-67.0kJ/mol,
根据盖斯定律,①-②可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=(-890.3kJ/mol)-(-67.0kJ/mol)=-823.3kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-823.3kJ/mol;
②8min时处于平衡状态,压强之比等于物质的量之比,则平衡时混合气体总物质的量为(0.1+0.2)mol×$\frac{6}{4.8}$=0.375mol,设参加反应的均为为xmol,则:
CH4(g)+2NO2(g)?CO2(g)+N2(g)+2H2O(g)
起始量(mol):0.1 0.2 0 0 0
变化量(mol):x 2x x x 2x
平衡量(mol):0.1-x 0.2-2x x x 2x
则:0.1-x+0.2-2x+x+x+2x=0.375,
解得:x=0.075,
则平衡常数为:K=$\frac{c(C{O}_{2})•c({N}_{2})•{c}^{2}({H}_{2}O)}{c(C{H}_{4})•{c}^{2}(N{O}_{2})}$=$\frac{\frac{0.075}{3}×\frac{0.075}{3}×(\frac{0.15}{3})^{2}}{\frac{0.025}{3}×(\frac{0.05}{3})^{2}}$=0.675,
故答案为:0.675;
(3)根据信息知道一氧化氮和二氧化氯之间反应生成产物是硝酸、盐酸以及二氧化氮,反应方程式为:2NO+ClO2+H2O=NO2+HNO3+HCl,根据物质的性质及化合价变化可知:2NO~5e-~NO2+HNO3,ClO2~5e-~HCl,所以有2NO2~ClO2,根据物质的性质及化合价变化可知:2NO2~8e-~N2,Na2SO3~2e-~Na2SO4,所以有2NO2~4 Na2SO3.根据关系式有:2ClO2~2NO2~N2,n(ClO2)=2n(NO2)=1 mol,m(ClO2)=67.5g,
故答案为:67.5.
点评 本题考查较为综合,涉及化学平衡的计算、氧化还原反应的计算、化学平衡及其影响等知识,题目难度较大,注意掌握化学平衡及其影响,明确三段式在化学平衡计算中的应用,试题培养了学生的分析能力及化学计算能力.

 阅读快车系列答案
阅读快车系列答案| 物 质 | 需加入的试剂 | 有关离子方程式 |
| Cu(Fe) | ||
| ZnSO4(CuSO4) | ||
| NaOH[Ca(OH)2] |
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molA、2molB | 6molA、4molB | 2molC |
| 达到平衡的时间/min | 5 | 8 | |
| A的浓度/mol•L-1 | C1 | C2 | |
| C的体积分数/% | ω1 | ω3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 若 x<4,2C1<C2 | |
| B. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短 | |
| C. | 无论x的值是多少,均有2ρ1=ρ2 | |
| D. | 若 x=4,则ω1=ω3 |
| 温度℃ | 700 | 800 | 880 | 1000 | 1200 |
| 平衡常数 | 1.0 | 10.0 | 15.0 | 16.1 | 17.7 |
(2)800℃时,向一个5L的密闭容器中充入0.4molA和0.7molB,若反应初始2mim内A的平均反应速率为0.01mol•L-1•min-1,则2min时c(A)=0.06mol•L-1,C的物质的量为0.1mol;此时,该可逆反应是否达到平衡?否(填“是”或“否”)
(3)在此密闭容器中,下列选项能作为判断该反应达到平衡的依据有abd
a.压强不随时间改变 b.气体的密度不随时间改变
c.单位时间内消耗A和B的物质的量相等 d.C的百分含量保持不变
(4)880℃时,反应 C(g)+D(s)?A(g)+B(g)的平衡常数的值为0.067.
①当温度由T1变化到T2时,平衡常数关系K1>K2(填“>”,“<”或“=”),焓变△H<0.(填“>”或“<”)
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为8.00×10-3mol/(L•min).
③T1温度下该反应的化学平衡常数K1=18.3.
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S>0(填“>”或“<”).
若已知:N2(g)+3H2(g)=2NH3(g)△H=a kJ/mol
2H2(g)+O2(g)=2H2O(l)△H=b kJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H=(2a-3b)kJ/mol(用含a、b的式子表示).
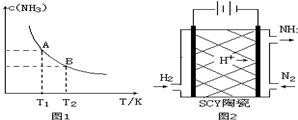
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图2所示,则阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)已知某些弱电解质在水中的电离平衡常数(25℃)如表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
①该溶液呈性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液呈碱性.
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是B.
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)


 对于反应2A(g)+B(g)?2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定:
对于反应2A(g)+B(g)?2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定: