题目内容
20.顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如图1转化:
该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数.
回答下列问题:
(1)已知:T1温度下,k(正)=0.006s-1,k(逆)=0.002s-1,该温度下反应的平衡常数值K1=3.
(2)T2温度下,图2中能表示顺式异构体的质量分数随时间变化的曲线是B(填曲线编号),平衡常数值K2=$\frac{7}{3}$;温度T2大于T1 (填“小于”“等于”或“大于”),判断理由是放热反应升高温度时平衡向逆反应方向移动.
分析 (1)根据v(正)=k(正)c(顺),k(正)=0.006s-1,以及v(逆)=k(逆)c(反),k(逆)=0.002s-1,结合化学平衡状态时正逆反应速率相等,可列出正、反浓度关系,可计算平衡常数;
(2)随着时间的推移,顺式异构体的质量分数不断减少,则符合条件的曲线是B,设顺式异构体的起始浓度为x,则可逆反应左右物质的系数相等,均为1,则平衡时,顺式异构体为0.3想,反式异构体为0.7x,所以平衡常数K2=$\frac{0.7x}{0.3x}$=$\frac{7}{3}$,以此解答该题.
解答 解:(1)根据v(正)=k(正)c(顺),k(正)=0.006s-1,则v(正)=0.006c(顺),v(逆)=k(逆)c(反),k(逆)=0.002s-1,则v(逆)=0.002c(反),化学平衡状态时正逆反应速率相等,则0.006c(顺)=0.002c(反),该温度下反应的平衡常数值K1=$\frac{c(正)}{c(反)}$=$\frac{0.006}{0.002}$=3,故答案为:3;
(2)随着时间的推移,顺式异构体的质量分数不断减少,则符合条件的曲线是B,设顺式异构体的起始浓度为x,则可逆反应左右物质的系数相等,均为1,则平衡时,顺式异构体为0.3想,反式异构体为0.7x,所以平衡常数K2=$\frac{0.7x}{0.3x}$=$\frac{7}{3}$,因为K1>K2,放热反应升高温度时平衡逆向移动,所以温度T2>T1,
故答案为:B;$\frac{7}{3}$;大于;放热反应升高温度时平衡向逆反应方向移动.
点评 本题考查化学平衡的计算,为2016年海南高考题,侧重于学生的分析、计算能力的考查,注意把握平衡常数的意义以及应用,解答时注意体会图象的涵义,为解答该题的重要突破,难度中等.

 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案| A. | 100mL2mol/LMgCl2溶液 | B. | 200mL2mol/LNaCl溶液 | ||
| C. | 250mL1mol/LAlCl3溶液 | D. | 100mL2mol/LKClO3溶液 |
| A. | 我国目前使用的主要能源是化石能源 | |
| B. | 氢能源的优点有:热量值高、对环境友好 | |
| C. | 核能发电是解决能源危机的最佳途径 | |
| D. | 太阳能的缺点有:能量密度低、稳定性差 |
| 物 质 | 需加入的试剂 | 有关离子方程式 |
| Cu(Fe) | ||
| ZnSO4(CuSO4) | ||
| NaOH[Ca(OH)2] |
(1)治理尾气中NO和CO的一种方法是:在汽车排气管上装一个催化转化装置,使二者发生反应转化成无毒无污染气体,该反应的化学方程式是2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
(2)活性炭也可用于处理汽车尾气中的NO.在1L恒容密闭容器中加入0.1000mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如下表:
| 活性炭/mol | NO/mol | A/mol | B/mol | p/MPa | |
| 200℃ | 2.00 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.050 | 0.0250 | 0.0250 | p |
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液.常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Kal(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=4.2×10-9.
(4)尾气中的碳氢化合物含有甲烷,其在排气管的催化转化器中可发生如下反应CH4(g)+H20(1)?CO(g)+3H2 (g)△H=+250.1kJ•mol-l.已知CO(g)、H2(g)的燃烧热依次为283.0kJ•mol-1、285.8kJmol-1,请写出表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol.以CH4(g)为燃料可以设计甲烷燃料电池,该电池以稀H2S04作电解质溶液,其负极电极反应式为CH4-8e-+2H2O=CO2+8H+,已知该电池的能量转换效率为86.4%,则该电池的比能量为13.4kW•h•kg-1(结果保留1位小数,比能量=$\frac{电池输出电能(kW•h)}{燃料质量(kg)}$,lkW•h=3.6×1 06J).
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molA、2molB | 6molA、4molB | 2molC |
| 达到平衡的时间/min | 5 | 8 | |
| A的浓度/mol•L-1 | C1 | C2 | |
| C的体积分数/% | ω1 | ω3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 若 x<4,2C1<C2 | |
| B. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短 | |
| C. | 无论x的值是多少,均有2ρ1=ρ2 | |
| D. | 若 x=4,则ω1=ω3 |
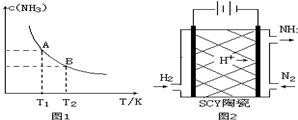
①当温度由T1变化到T2时,平衡常数关系K1>K2(填“>”,“<”或“=”),焓变△H<0.(填“>”或“<”)
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为8.00×10-3mol/(L•min).
③T1温度下该反应的化学平衡常数K1=18.3.
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S>0(填“>”或“<”).
若已知:N2(g)+3H2(g)=2NH3(g)△H=a kJ/mol
2H2(g)+O2(g)=2H2O(l)△H=b kJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H=(2a-3b)kJ/mol(用含a、b的式子表示).
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图2所示,则阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)已知某些弱电解质在水中的电离平衡常数(25℃)如表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
①该溶液呈性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液呈碱性.
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是B.
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
| A. | 用托盘天平称量25.21 g氯化钠 | B. | 用10 mL量筒量取7.50 mL稀硫酸 | ||
| C. | 用25 mL滴定管量取14.86 mL溶液 | D. | 用广泛pH试纸测得溶液的pH为4.2 |
