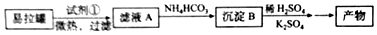题目内容
2.下列说法正确的是( )| A. | 正反应是放热反应的可逆反应,升高温度v(正)>v(逆) | |
| B. | 加压可使速率加快,是因为增加活化分子百分数而使反应速率加快 | |
| C. | 活化分子的碰撞不一定都能发生化学反应 | |
| D. | 催化剂可改变反应进程,故加催化剂改变了一个反应的△H |
分析 A.正反应是放热反应的可逆反应,升高温度平衡逆向移动;
B、加压改变单位体积内活化分子总数;
C、当发生化学反应的碰撞才是有效碰撞;
D.催化剂不影响反应热.
解答 解:A.正反应是放热反应的可逆反应,升高温度平衡逆向移动,则正反应速率小于逆反应速率,故A错误;
B、加压改变单位体积内活化分子总数,而活化分子的百分数不变,故B错误;
C、活化分子之间的碰撞不一定为有效碰撞,当发生化学反应的碰撞才是有效碰撞,故C正确;
D.催化剂不影响反应热,故D错误.
故选C.
点评 本题考查活化能及其对反应速率的影响,题目难度不大,注意活化分子、有效碰撞以及活化能等概念的理解.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
12.下列反应属于氧化还原反应的是( )
| A. | CO2+H2O=H2CO3 | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CO2↑+CaO | ||
| C. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | D. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$NaCl |
13.Na2S溶液中存在多种离子和分子.下列关系不正确的是( )
| A. | c(Na+)+c(H+)=c(OH-)+2c(S2-)+c(HS-) | B. | c(OH-)=c(HS-)+c(H+)+2c(H2S) | ||
| C. | c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | D. | c(OH-)=c(HS-)+c(H+)+c(H2S) |
11.下列溶液中Cl-的物质的量浓度与200mL1mol/L BaCl2溶液中Cl-的物质的量浓度相同的是( )
| A. | 100mL2mol/LMgCl2溶液 | B. | 200mL2mol/LNaCl溶液 | ||
| C. | 250mL1mol/LAlCl3溶液 | D. | 100mL2mol/LKClO3溶液 |
9.T℃时,在容积为2L的3个恒容密闭容器中发生反应:3A(g)+B(g)?xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molA、2molB | 6molA、4molB | 2molC |
| 达到平衡的时间/min | 5 | 8 | |
| A的浓度/mol•L-1 | C1 | C2 | |
| C的体积分数/% | ω1 | ω3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 若 x<4,2C1<C2 | |
| B. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短 | |
| C. | 无论x的值是多少,均有2ρ1=ρ2 | |
| D. | 若 x=4,则ω1=ω3 |