题目内容
19.0.1mol/L的NH3•H2O溶液中 NH3•H2O?NH4++OH-,对于该平衡,下列叙述正确的是( )| A. | 加水时,平衡向逆反应方向移动 | |
| B. | 通入少量HCl,平衡向正反应方向移动 | |
| C. | 加入少量0.1mol/LNaOH,溶液中c(OH-)减小 | |
| D. | 加入少量NH4Cl固体,平衡向逆反应方向移动 |
分析 A.依据浓度对弱电解质电离平衡移动影响解答;
B.加入氯化氢,氢离子浓度增大;
C.氢氧化钠为强电解质,完全电离;
D.依据同离子效应解答.
解答 解:A.加水稀释,各离子浓度都减小,但是C(NH4+)和C(OH-)的减小比C(NH3•H2O)的减小更多,依据平衡移动原理,电离平衡正向移动,故A错误;
B.加入氯化氢,氢离子浓度增大,依据平衡移动原理,电离平衡逆向移动,故B错误;
C.加入少量0.1mol/LNaOH,氢氧化钠为强电解质,完全电离,溶液中c(OH-)增大,故C错误;
D.加入少量NH4Cl固体,铵根离子浓度增大,平衡向逆反应方向移动,故D正确;
故选:D.
点评 本题考查了弱电解质电离平衡的移动,弱电解质电离平衡遵循化学平衡移动规律,熟悉浓度对平衡移动的影响是解题关键,题目难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
1.下列反应的离子方程式中,正确的是( )
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙溶液跟盐酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 盐酸跟氢氧化镁溶液反应:H++OH-═H2O | |
| D. | 氢氧化钡跟硫酸铜反应:Ba2++SO42-═BaSO4↓ |
7. 2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰.可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料.
2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰.可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料.
(1)甲烷和二氧化碳重整制合成气,对于温室气体的治理具有重大意义.
已知:CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247.3kJ•mol-1
CH4(g)?C(s)+2H2(g)△H=+75kJ•mol-1
①反应2CO(g)═C(s)+CO2(g)在一定条件下能自发进行的原因是△H<0.
②合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1,T℃下此反应的平衡常数为160.某时刻测得各组分的浓度如下:
比较此时正、逆反应速率的大小:v(正)>v(逆)(填“>”、“<”或“=”).生产过程中,合成气要进行循环,其目的是提高原料的利用率.
③在一恒容密闭容器中,要提高反应2H2(g)+CO(g)?CH3OH(g) 中CO的转化率,可以采取的措施是df.
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2 e.加入惰性气体 f.分离出甲醇
(2)以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图(如图).
①B极为电池负极,电极反应式为CH4+4O2--8e-=CO2+2H2O.
②若用该燃料电池作电源,用石墨作电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为1.12 L(标况下).
 2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰.可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料.
2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰.可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料.(1)甲烷和二氧化碳重整制合成气,对于温室气体的治理具有重大意义.
已知:CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247.3kJ•mol-1
CH4(g)?C(s)+2H2(g)△H=+75kJ•mol-1
①反应2CO(g)═C(s)+CO2(g)在一定条件下能自发进行的原因是△H<0.
②合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1,T℃下此反应的平衡常数为160.某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.20 | 0.10 | 0.40 |
③在一恒容密闭容器中,要提高反应2H2(g)+CO(g)?CH3OH(g) 中CO的转化率,可以采取的措施是df.
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2 e.加入惰性气体 f.分离出甲醇
(2)以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图(如图).
①B极为电池负极,电极反应式为CH4+4O2--8e-=CO2+2H2O.
②若用该燃料电池作电源,用石墨作电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为1.12 L(标况下).
4.合成氨工业对化学工业和国防工业具有重要意义,对农业生产起着重要作用.
(1)已知:N2(g)+O2(g)=2NO(g)△H1
H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H2
4NH3(g)+5O2(g)=4NO(g)+6H2O(1)△H3
N2(g)+3H2(g)?2NH3(g)△H4<0
则△H4=△H1+3△H2-$\frac{1}{2}$△H3(用含△H1、△H2、△H3的代数式表示).
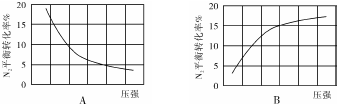
(2)在其他条件相同时,分别测定合成氨反应中N2的平衡转化率随压强变化的曲线如图A、B所示,其中正确的是B(填“A”或“B”),其判断理由是合成氨反应为气体分子数减小的反应,增大压强,平衡正移,反应物的转化率增大.
(3)在体积为2L的密闭容器中按物质的量1:3的比例充入N2、H2,进行下列四组合成氨实验:
①实验Ⅰ前10秒的平均速率v(NH3)=0.0011mol•L-1•s-1,T1温度下合成氨反应的平衡常数K=$\frac{0.022}{0.04×0.123}$ (mol•L-1)-2(列出计算式).
②与实验Ⅰ相比,实验Ⅱ改变了一个条件,该条件可能是加催化剂.
③与实验I相比,实验Ⅲ中N2的平衡转化率增大(填“增大”、“减小”或“不变”),平衡常数K不变(填“增大”、“减小”或“不变”).
④实验Ⅲ与实验Ⅳ的反应条件温度不同,则T1小于(填“大于”、“小于”或“等于”)T2,原因是T2时的平衡常数小于T1时的平衡常数且正反应放热.
(1)已知:N2(g)+O2(g)=2NO(g)△H1
H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H2
4NH3(g)+5O2(g)=4NO(g)+6H2O(1)△H3
N2(g)+3H2(g)?2NH3(g)△H4<0
则△H4=△H1+3△H2-$\frac{1}{2}$△H3(用含△H1、△H2、△H3的代数式表示).
(2)在其他条件相同时,分别测定合成氨反应中N2的平衡转化率随压强变化的曲线如图A、B所示,其中正确的是B(填“A”或“B”),其判断理由是合成氨反应为气体分子数减小的反应,增大压强,平衡正移,反应物的转化率增大.

(3)在体积为2L的密闭容器中按物质的量1:3的比例充入N2、H2,进行下列四组合成氨实验:
| 组别 | 温度 | N2起始量/mol | N2的物质的量/mol | ||||||
| 5(s) | 10(s) | 15(s) | 20(s) | 25(s) | 30(s) | 35(s) | |||
| Ⅰ | T1 | 0.1 | 0.094 | 0.089 | 0.085 | 0.0825 | 0.081 | 0.080 | 0.080 |
| Ⅱ | T2 | 0.1 | 0.090 | 0.085 | 0.082 | 0.080 | 0.080 | 0.080 | 0.080 |
| Ⅲ | T3 | 0.2 | 0.179 | 0.165 | 0.153 | 0.146 | x | x | x |
| Ⅳ | T4 | 0.2 | 0.173 | 0.161 | 0.155 | 0.150 | 0.150 | 0.150 | 0.150 |
②与实验Ⅰ相比,实验Ⅱ改变了一个条件,该条件可能是加催化剂.
③与实验I相比,实验Ⅲ中N2的平衡转化率增大(填“增大”、“减小”或“不变”),平衡常数K不变(填“增大”、“减小”或“不变”).
④实验Ⅲ与实验Ⅳ的反应条件温度不同,则T1小于(填“大于”、“小于”或“等于”)T2,原因是T2时的平衡常数小于T1时的平衡常数且正反应放热.
11.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s),△H=-216kJ•mol-1,反应物总能量小于生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1mol氢分子的能量为E2,则2E1>E2 | |
| C. | 101kPa时,2H2(g)+O2(g)=2H2O(1),△H=-571.6kJ•mol-1,若生成气态水,△H小于-571.6kJ•mol-1 | |
| D. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
8.A~H均为短周期元素,A~F在元素周期表中的相对位置如图所示,G与其它七种元素不在同一周期,H是短周期中原子半径最大的主族元素.由B、G组成的气态化合物甲水溶液呈碱性.
请回答下列问题:
(1)写出甲的电子式 ,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)B、C、G个数比为1:1:5形成的化合物的化学键类型为b.
A.离子键 B. 极性键 C. 非极性键
(3)请用电子式表示AE2的形成过程 .
.
(4)用离子符号表示C、E、F、H四种离子的半径由大到小的顺序S2->Cl->O2->Na+.
(5)用一个离子方程式解释A比D非金属性强的原因CO2+H2O+SiO32-=CO32-+H2SiO3↓.
(6)D的氧化物晶体类型为原子晶体,12g D的氧化物中含有的共价键数为0.8NA(NA为阿伏加德罗常数的值).
(7)B、G可以形成电子总数为18的化合物乙,则乙的结构式为 .
.
| A | B | C | |
| D | E | F |
(1)写出甲的电子式
 ,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.(2)B、C、G个数比为1:1:5形成的化合物的化学键类型为b.
A.离子键 B. 极性键 C. 非极性键
(3)请用电子式表示AE2的形成过程
 .
.(4)用离子符号表示C、E、F、H四种离子的半径由大到小的顺序S2->Cl->O2->Na+.
(5)用一个离子方程式解释A比D非金属性强的原因CO2+H2O+SiO32-=CO32-+H2SiO3↓.
(6)D的氧化物晶体类型为原子晶体,12g D的氧化物中含有的共价键数为0.8NA(NA为阿伏加德罗常数的值).
(7)B、G可以形成电子总数为18的化合物乙,则乙的结构式为
 .
.
9.有以下四种物质:①标况下11.2LCO2 ②1g H2③1.204×1024个N2④4℃时18mlH2O,下列说法不正确的是( )
| A. | 分子个数:③>④>①=② | B. | 原子个数:③>④>①>② | ||
| C. | 质 量:③>①>④>② | D. | 体 积:③>④>①=② |