题目内容
7. 2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰.可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料.
2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰.可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料.(1)甲烷和二氧化碳重整制合成气,对于温室气体的治理具有重大意义.
已知:CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247.3kJ•mol-1
CH4(g)?C(s)+2H2(g)△H=+75kJ•mol-1
①反应2CO(g)═C(s)+CO2(g)在一定条件下能自发进行的原因是△H<0.
②合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1,T℃下此反应的平衡常数为160.某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.20 | 0.10 | 0.40 |
③在一恒容密闭容器中,要提高反应2H2(g)+CO(g)?CH3OH(g) 中CO的转化率,可以采取的措施是df.
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2 e.加入惰性气体 f.分离出甲醇
(2)以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图(如图).
①B极为电池负极,电极反应式为CH4+4O2--8e-=CO2+2H2O.
②若用该燃料电池作电源,用石墨作电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为1.12 L(标况下).
分析 (1)①结合反应自发进行的判断依据是△H-T△S<0分析判断;
②计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向,生产过程中,合成气要进行循环,是充分利用原料,提高原料的利用率;
③要提高CO的转化率,必须使可逆反应向正反应方向移动;
(2)①由阴离子移动方向可知B为负极,负极发生氧化反应,甲烷被氧化生成二氧化碳和水;
②开始阶段发生反应:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令是氢气为xmol,根据电子转移守恒列方程计算,再根据电子转移守恒计算消耗的甲烷;根据电池中的能量转化率分析.
解答 解:(1)①CH4(g)+CO2(g)?2CO(g)+2H2(g)△H=+247.3kJ•mol-1
CH4(g)?C(s)+2H2(g)△H=+75kJ•mol-1
①反应2CO(g)═C(s)+CO2(g),反应气体体积减小△S<0,满足在一定条件下能自发进行,△H-T△S<0则一定存在△H<0,反应2CO(g)═C(s)+CO2(g)在一定条件下能自发进行的原因是△H<0,
故答案为:△H<0;
②①由表中数据可知,10min时氢气的浓度为0.2mol/L、CO的浓度为0.1mol/L、甲醇的浓度为0.4mol/L,则此时的浓度商Qc=$\frac{0.4}{0.{2}^{2}×0.1}$=100,小于平衡常数160,故反应向正反应方向进行,故V正>V逆,生产过程中,合成气要进行循环,这样可以提高原料利用率,
故答案为:>;提高原料的利用率;
③(3)a.该反应是放热反应,升高温度平衡向逆反应方向移动,故错误;
b.催化剂对平衡移动无影响,故错误;
c.增加CO的浓度,平衡向正反应方向移动,但CO的转化率降低,故错误;
d.加入H2加压,平衡向正反应方向移动,一氧化碳的转化率增大,故正确;
e.加入惰性气体加压,参加反应的气体压强不变,平衡不移动,故错误;
f.分离出甲醇,平衡向正反应方向移动,一氧化碳的转化率增大,故正确;
故选df,
故答案为:df;
(2)①由阴离子移动方向可知B为负极,负极发生氧化反应,甲烷被氧化生成二氧化碳和水,电极方程式为CH4+4O2--8e-=CO2+2H2O,
故答案为:负;CH4+4O2--8e-=CO2+2H2O;
②硫酸铜的物质的量=0.1L×2mol/L=0.2mol,开始阶段发生反应:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,铜离子完全放电后,发生反应2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,当两极收集到的气体体积相等时,即氢气与氧气的体积相等,令是氢气为xmol,根据电子转移守恒,则:0.1mol×2+2x=4x,解得x=0.1,
根据电子转移守恒,可知消耗的甲烷物质的量=$\frac{0.1mol×4}{8}$=0.05mol,故消耗甲烷的体积=0.05mol×22.4L/mol=1.12L,
故答案为:1.12 L.
点评 本题综合考查影响化学平衡移动的因素、平衡状态的判断、电化学知识,为高频考点,侧重于学生的分析、计算能力的考查,解答本题要注意把握原电池的工作原理和化学平衡移动原理,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 在标准状况下,22.4L N2与CO混合气体的质量为28g | |
| B. | 常温常压下,金属与酸反应生成2gH2,转移电子数为2NA | |
| C. | 含0.2NA个阴离子的Na2O2和水反应时,转移0.2mol电子22.4L | |
| D. | 1L含NA个NH3•H2O的氨水,其浓度为1mol•L-1 |
| A. | 在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 | |||||||||
| B. | H2(g)+Br2(g)═2HBr(g)△H=-72kJ•mol-1其它相关数据如下表:
| |||||||||
| C. | 在隔绝空气下,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则热化学方程式为Fe(s)+S(s)═FeS(s);△H=-95.6 kJ•mol-1 | |||||||||
| D. | 若2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为-241.8 kJ•mol-1 |
| A. | 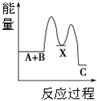 反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0),图表示总反应过程中能量变化 | |
| B. | 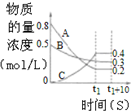 图表示反应的化学方程式为3A+B═2C | |
| C. | 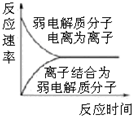 图表示弱电解质在水中建立电离平衡的过程 | |
| D. | 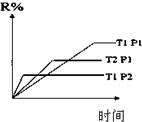 图表示反应M(g)+N(g)?R(g)+2L(?)是放热反应且L是气体 |
 丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机.
丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机.(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇(CH3OH)蒸汽和水蒸气CO2(g)+3H2(g)?CH3OH(g)+H2O(g).如图表示恒压容器中充入1mol CO2和3mol H2,转化率达50%时放出热量19.6KJ写出该反应的热化学方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-39.2 kJ•mol-1.
(2)另外工业上还可用CO和H2制备甲醇. 反应为CO(g)+2H2(g)═CH3OH(g),某温度下,在容积为2L的恒容密闭容器中进行该反应,其相关数据如图:t min至2t min时速率变化的原因可能是升温或使用了催化剂;
(3)CO2在一定条件下,还可以与H2合成二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g).
将2.5mol H2与b mol CO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得实验数据如表:
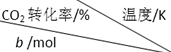 | 500 | 600 | 700 | 800 |
| 1.67 | X | 33 | ||
| 1.25 | 60 | 43 | Y | |
| 0.83 | Z | 32w |
②表中y、z的大小关系为B.
A.y=z B.y>z C.y<z D.无法判断
③表中x、y、z、w对应的平衡常数分别为Kx、Ky、Kz、Kw,它们之间的大小关系为Kx>Kz>Ky=Kw.
| A. | 加水时,平衡向逆反应方向移动 | |
| B. | 通入少量HCl,平衡向正反应方向移动 | |
| C. | 加入少量0.1mol/LNaOH,溶液中c(OH-)减小 | |
| D. | 加入少量NH4Cl固体,平衡向逆反应方向移动 |
| A. | 增加LaNi5H6(s)的量 | B. | 降低温度 | ||
| C. | 减小压强 | D. | 使用催化剂 |
 W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):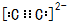 ,基态R原子的价电子排布式为3d64s2.
,基态R原子的价电子排布式为3d64s2.