题目内容
8.A~H均为短周期元素,A~F在元素周期表中的相对位置如图所示,G与其它七种元素不在同一周期,H是短周期中原子半径最大的主族元素.由B、G组成的气态化合物甲水溶液呈碱性.| A | B | C | |
| D | E | F |
(1)写出甲的电子式
 ,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.(2)B、C、G个数比为1:1:5形成的化合物的化学键类型为b.
A.离子键 B. 极性键 C. 非极性键
(3)请用电子式表示AE2的形成过程
 .
.(4)用离子符号表示C、E、F、H四种离子的半径由大到小的顺序S2->Cl->O2->Na+.
(5)用一个离子方程式解释A比D非金属性强的原因CO2+H2O+SiO32-=CO32-+H2SiO3↓.
(6)D的氧化物晶体类型为原子晶体,12g D的氧化物中含有的共价键数为0.8NA(NA为阿伏加德罗常数的值).
(7)B、G可以形成电子总数为18的化合物乙,则乙的结构式为
 .
.
分析 A~H均为短周期元素,由A~F在元素周期表中的相对位置,可知A、B、C处于第二周期,而D、E、F处于第三周期,H是短周期中原子半径最大的主族元素,则H为Na;由B、G组成的气态化合物甲水溶液呈碱性,该化合物为NH3,G与其它七种元素不在同一周期,可推知G为H元素、B为N元素,结合A~F在元素周期表中的相对位置,可知A为碳元素、C为O元素、D为Si、E为S、F为Cl,以此解答该题.
解答 解:(1)甲为NH3,电子式为 ,实验室制取NH3的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
,实验室制取NH3的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为: ;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)N、O、H个数比为1:1:5形成的化合物为NH3.H2O,含有化学键为极性键,
故选:b;
(3)请用电子式表示CS2的形成过程: ,
,
故答案为: ;
;
(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多,离子半径越大,故离子半径:S2->Cl->O2->Na+,
故答案为:S2->Cl->O2->Na+;
(5)可以利用最高价含氧酸的酸性说明C比Si非金属性强,反应离子方程式为:CO2+H2O+SiO32-=CO32-+H2SiO3↓,
故答案为:CO2+H2O+SiO32-=CO32-+H2SiO3↓;
(6)D为Si,对应的氧化物为原子晶体,12g二氧化硅的物质的量为$\frac{12g}{60g/mol}$=0.2mol,而1mol二氧化硅含有4mol共价键,则0.2mol二氧化硅含有0.8个共价键,
故答案为:原子晶体;0.8NA;
(7)B、G可以形成电子总数为18的化合物为联氨,联氨是共价化合物氮原子和氢原子形成共价键,氮原子和氮原子间也形成共价键,结构式为: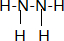 ,
,
故答案为: .
.
点评 本题考查结构性质位置关系应用,推断元素涉及解题关键,注意用电子式表示化学键或物质的性质,注意金属性、非金属性强弱比较实验事实.

 初中学业考试导与练系列答案
初中学业考试导与练系列答案| A. | 在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 | |||||||||
| B. | H2(g)+Br2(g)═2HBr(g)△H=-72kJ•mol-1其它相关数据如下表:
| |||||||||
| C. | 在隔绝空气下,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则热化学方程式为Fe(s)+S(s)═FeS(s);△H=-95.6 kJ•mol-1 | |||||||||
| D. | 若2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为-241.8 kJ•mol-1 |
| A. | 加水时,平衡向逆反应方向移动 | |
| B. | 通入少量HCl,平衡向正反应方向移动 | |
| C. | 加入少量0.1mol/LNaOH,溶液中c(OH-)减小 | |
| D. | 加入少量NH4Cl固体,平衡向逆反应方向移动 |
| A. | 已知冰的融化热为6.0kJ.mol-1,冰中氢键键能为20kJ.mol-1.假设每摩尔冰中有2 mol 氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,Ka=$\frac{(ca)^{2}}{c(1-a)}$.若加入少量CH3COONa固体,则电离平衡CH3COOH?CH3COO-+H+向左移动,a减小,Ka变小 | |
| C. | 实验测得环己烷(1).环己烯(1)和苯(1)的标准燃烧热分别为-3916kJ.mol-1、-3747kJ.mol-1和-3265kJ.mol-1,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 已知:Fe2O3(s)+3C(石墨)═92Fe(s)+3CO(g)△H=489.0kJ.mol-1 CO(g)+$\frac{1}{2}$O2(g)═9CO2(g)△H=-283.0kJ.mol-1 C(石墨)+O2(g)═9CO2(g)△H=-393.5kJ.mol-1 则4Fe(s)+3O2(g)=94Fe2O3(s)△H=-1641.0kJ.mol-1 |
| A. | 稀醋酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol | |
| B. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ/mol | |
| C. | 氢气的燃烧热为285.8 kJ/mol,则水电解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.8 kJ/mol | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ/mol,则可知C的燃烧热为11.5KJ/mol |
| A. | 增加LaNi5H6(s)的量 | B. | 降低温度 | ||
| C. | 减小压强 | D. | 使用催化剂 |
①Al
②Al2O3
③Al(OH)3
④Na2CO3溶液
⑤Ca(HCO3)2溶液
⑥KHSO4溶液.
| A. | ①②③⑥ | B. | ①②③④ | C. | ①②③⑤ | D. | ①②③④⑤ |
 W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):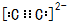 ,基态R原子的价电子排布式为3d64s2.
,基态R原子的价电子排布式为3d64s2.