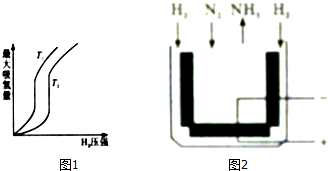
题目内容
11.下列关于反应能量的说法正确的是( )| A. | Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s),△H=-216kJ•mol-1,反应物总能量小于生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1mol氢分子的能量为E2,则2E1>E2 | |
| C. | 101kPa时,2H2(g)+O2(g)=2H2O(1),△H=-571.6kJ•mol-1,若生成气态水,△H小于-571.6kJ•mol-1 | |
| D. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
分析 A、反应是放热反应,依据能量守恒分析;
B、原子能量高于分子能量,形成化学键放出能量;
C、液态水变化为气态水需要吸热,焓变为负值分析比较;
D、化石燃料燃烧产生污染性气体,污染环境.
解答 解:A、Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)△H=-216 kJ/mol,反应放热,反应物总能量大于生成物总能量,故A错误;
B、原子能量高于分子能量,形成化学键放出能量,相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子所具有的能量为E2,则2E2>E1,故B正确;
C、液态水变化为气态水需要吸热,焓变为负值分析比较,101KPa时,2H2(g)+O2(g)=2H2O(l)△H=-517.6 kJ/mol,若生成气态水,△H大于-517.6 kJ/mol,故C错误;
D、利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境,利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境,故D正确;
故选BD.
点评 本题考查了反应热量变化焓变的意义分析判断,物质能量守恒是解题关键,题目难度中等.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
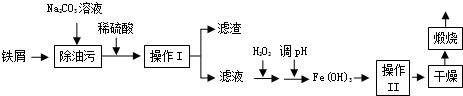
2.下列图示与对应的叙述不相符合的是( )
| A. | 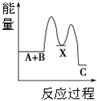 反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0),图表示总反应过程中能量变化 | |
| B. | 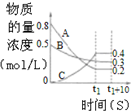 图表示反应的化学方程式为3A+B═2C | |
| C. | 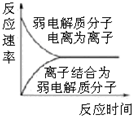 图表示弱电解质在水中建立电离平衡的过程 | |
| D. | 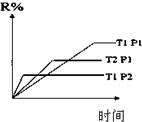 图表示反应M(g)+N(g)?R(g)+2L(?)是放热反应且L是气体 |
19.0.1mol/L的NH3•H2O溶液中 NH3•H2O?NH4++OH-,对于该平衡,下列叙述正确的是( )
| A. | 加水时,平衡向逆反应方向移动 | |
| B. | 通入少量HCl,平衡向正反应方向移动 | |
| C. | 加入少量0.1mol/LNaOH,溶液中c(OH-)减小 | |
| D. | 加入少量NH4Cl固体,平衡向逆反应方向移动 |
20.有关热化学方程式书写与对应表述均正确的是( )
| A. | 稀醋酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol | |
| B. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ/mol | |
| C. | 氢气的燃烧热为285.8 kJ/mol,则水电解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.8 kJ/mol | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ/mol,则可知C的燃烧热为11.5KJ/mol |
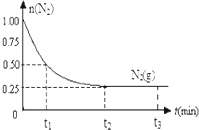 一定温度下,在体积为2L的恒容密闭容器中充入1mol N2和3mol H2,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),测得其中N2(g)物质的量随时间变化如图.
一定温度下,在体积为2L的恒容密闭容器中充入1mol N2和3mol H2,一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),测得其中N2(g)物质的量随时间变化如图. W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.基态W的原子核外有2个未成对电子,Q是电负性最大的元素,基态R的原子核外未成对电子数是W原子核外未成对电子数的2倍.请问答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):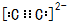 ,基态R原子的价电子排布式为3d64s2.
,基态R原子的价电子排布式为3d64s2.