��Ŀ����
14���״���һ�ֻ������л�����ԭ�Ϻ�����ȼ�ϣ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ��������¿��Ժϳɼ״�����Ҫ��Ӧ���£���CO��g��+2H2��g��?CH3OH��g����H1=-100kJ•mol-1
��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H2=-58kJ•mol-1
��CO2��g��+H2��g��?CO��g��+H2O��g����H3
�ش��������⣺
��1����H3=+42kJ•mol-1��
��2����Ӧ�١��ڡ��۶�Ӧ��ƽ�ⳣ��K1��K2��K3֮��Ĺ�ϵ��K1=$\frac{{K}_{2}}{{K}_{3}}$�������¶ȵ����ߣ�K3�������С�����������䡱����
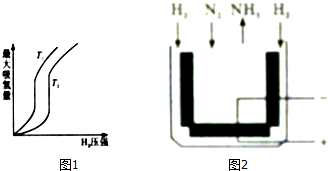
��3���ϳ������$\frac{n��{H}_{2}��}{n��CO+C{O}_{2}��}$=2.60ʱ����ϵ�е�COƽ��ת���ʣ��������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ1��ʾ��ͼ��ѹǿ��С�����˳��Ϊp1��p2��p3��

��4��ͼ2��ij�о����������ĸ��ʼDZ����Թ���ļ״�ȼ�ϵ�أ��״��ڴ����������ṩ���ӣ�H+���͵��ӣ��为���ĵ缫��ӦʽΪCH3OH+H2O-6e-=CO2+6H+��
���� ��1���ɢ�CO��g��+2H2��g��?CH3OH��g����H1=-100kJ•mol-1
��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H2=-58kJ•mol-1
��ϸ�˹���ɿ�֪����-�ٵõ�CO2��g��+H2��g��?CO��g��+H2O��g����
��2����=��-�٣���KΪָ����ϵ�������¶�ƽ�������ȵķ����ƶ���
��3����ͼ��֪$\frac{n��{H}_{2}��}{n��CO+C{O}_{2}��}$=2.60ʱ����ͬ�¶��£�����ѹǿ��������ƽ��������Ӧ�����ƶ���CO��ת��������
��4���״��ڴ����������ṩ���ӣ�H+���͵��ӣ����ϼ״�ʧȥ�������ɶ�����̼��
��� �⣺��1���ɢ�CO��g��+2H2��g��?CH3OH��g����H1=-100kJ•mol-1
��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H2=-58kJ•mol-1
��ϸ�˹���ɿ�֪����-�ٵõ�CO2��g��+H2��g��?CO��g��+H2O��g�������H3=��-58kJ•mol-1��-��-100kJ•mol-1��=+42kJ•mol-1��
�ʴ�Ϊ��+42��
��2����=��-�٣���֪��=��-�ۣ���K1=$\frac{{K}_{2}}{{K}_{3}}$����Ϊ���ȷ�Ӧ�������¶ȵ����ߣ�ƽ�������ƶ���K3����
�ʴ�Ϊ��$\frac{{K}_{2}}{{K}_{3}}$������
��3����ͬ�¶��£���Ӧ��ǰ��������������䣬ѹǿ�ı䲻Ӱ����ƽ���ƶ�����Ӧ�٢ڵ�����Ӧ��Ϊ�����������С�ķ�Ӧ������ѹǿ��������ƽ��������Ӧ�����ƶ���CO��ת������������ѹǿ������CO��ת�������ߣ����ͼ��֪�����Ϸ�ѹǿ��Ӧת���������ѹǿΪp1��p2��p3��
�ʴ�Ϊ��p1��p2��p3��
��4���״��ڴ����������ṩ���ӣ�H+���͵��ӣ����ϼ״�ʧȥ�������ɶ�����̼��������ӦΪCH3OH+H2O-6e-=CO2+6H+��
�ʴ�Ϊ��CH3OH+H2O-6e-=CO2+6H+��
���� ���⿼�鷴Ӧ�����ʱ䡢ƽ�ⳣ����ƽ���ƶ���ԭ��أ�Ϊ��Ƶ���㣬���ո�˹����Ӧ�á���Ӧ�Ĺ�ϵ��ƽ���ƶ�ԭ�����缫��Ӧ��дΪ���Ĺؼ������ط�����Ӧ�������Ŀ��飬�ۺ��Խ�ǿ����Ŀ�ѶȲ���

 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�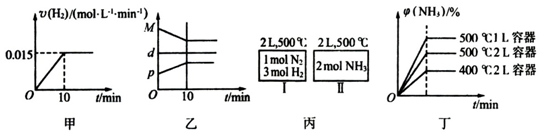
| A�� | ���ﵽƽ��ʱ�������ϵ�ų�9.24kJ��������H2��Ӧ���ʱ仯������ͼ����ʾ | |
| B�� | ��Ӧ�����У��������ƽ����Է�������ΪM����������ܶ�Ϊd���������ѹǿΪp�����߹�ϵ��ͼ�� | |
| C�� | ��ͼ����ʾ������I��II�ﵽƽ��ʱ��NH3���������Ϊ�գ�������I�ų�����������II��������֮��Ϊ92.4kJ | |
| D�� | ����ʼ��������Ϊ1 mol N2��3 mol H2���ڲ�ͬ�����´ﵽƽ��ʱ��NH3����������仯��ͼ����ʾ |
| A�� | 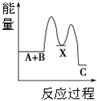 ��ӦA+B��C����H��0�����������У���A+B��X����H��0������X��C����H��0����ͼ��ʾ�ܷ�Ӧ�����������仯 | |
| B�� | 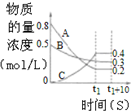 ͼ��ʾ��Ӧ�Ļ�ѧ����ʽΪ3A+B�T2C | |
| C�� | 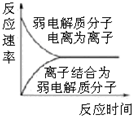 ͼ��ʾ���������ˮ�н�������ƽ��Ĺ��� | |
| D�� | 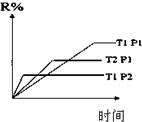 ͼ��ʾ��ӦM��g��+N��g��?R��g��+2L�������Ƿ��ȷ�Ӧ��L������ |
| A�� | ��ˮʱ��ƽ�����淴Ӧ�����ƶ� | |
| B�� | ͨ������HCl��ƽ��������Ӧ�����ƶ� | |
| C�� | ��������0.1mol/LNaOH����Һ��c��OH-����С | |
| D�� | ��������NH4Cl���壬ƽ�����淴Ӧ�����ƶ� |
| A�� | Ũ�����Ũ�����ˮϡ�ͺ��������ͭ��Ӧ | |
| B�� | Ũ�����Ũ���ᶼ��������ֱ�Ӹ�п����Ӧ������ | |
| C�� | Ũ�����Ũ�����ڳ����¶����ý�����������ʢ�� | |
| D�� | Ũ�����Ũ���ᶼ���뵥��̼��Ӧ |

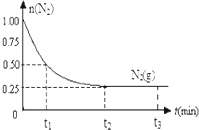 һ���¶��£������Ϊ2L�ĺ����ܱ������г���1mol N2��3mol H2��һ�������·�����Ӧ��N2��g��+3H2��g��?2NH3��g�����������N2��g�����ʵ�����ʱ��仯��ͼ��
һ���¶��£������Ϊ2L�ĺ����ܱ������г���1mol N2��3mol H2��һ�������·�����Ӧ��N2��g��+3H2��g��?2NH3��g�����������N2��g�����ʵ�����ʱ��仯��ͼ��