题目内容
16.现用质量分数为98%,密度为1.84g/cm3的浓硫酸来配制200ml 1mol/L的稀硫酸,可供选择的仪器有:①量筒 ②烧杯 ③胶头滴管 ④玻璃棒.(1)除上述仪器中,配制过程中还差的有250mL的容量瓶.
(2)计算所需浓硫酸的体积为13.6mL.现有①5ml ②10ml ③20ml④50ml四种规格的量筒,最好选用③.(填代号)
(3)在配制过程中,下列操作可引起所配溶液浓度偏低的有④⑤.(填代号)
①洗涤量取浓硫酸的量筒,并将洗涤液转移到定量瓶中.
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
⑤定容量,仰视刻度线.
分析 (1)根据操作步骤选取实验仪器,根据仪器的用途来分析需要查漏的仪器以及查漏的方法;
(2)根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸溶液的体积;根据浓硫酸的体积选取量筒,注意所选量筒的容积应稍大于或等于量取溶液的体积;
(3)根据c=$\frac{n}{V}$,分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答 解:(1)配制200ml 1mol/L的稀硫酸,配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸溶液在烧杯中稀释,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、量筒、胶头滴管、小烧杯、250ml容量瓶,实验室没有200ml容量瓶,
故答案为:250mL的容量瓶;
(2)浓硫酸的物质的量浓度为c=$\frac{1000ρw}{M}$=18.4mol/L;设需要浓硫酸的体积为V,1mol/L×250mL=18.4mol/L×V,V=13.6mL,量筒的容积应稍大于或等于量取溶液的体积,
故答案为:13.6mL;③;
(3)①洗涤量取浓硫酸的量筒,并将洗涤液转移到定量瓶中,使得硫酸溶质偏多,浓度偏高;
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中,根据热胀冷缩的原理,体积缩小,浓度偏高;
③转移前,容量瓶中含有少量蒸馏水,对所配制溶液浓度无影响;
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒,造成硫酸溶质损失,浓度偏低;
⑤定容时,仰视刻度线,会导致溶液体积偏大,则溶液浓度偏低;
故能引起所配稀硫酸的浓度偏低的是④⑤,
故答案为:④⑤.
点评 本题考查了一定物质的量浓度溶液的配制,难度不大,会根据量取溶液的体积正确选取量筒.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.已知 25℃时有关弱酸的电离平衡常数:则下列说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 等物质的量浓度的各溶液 pH 关系为:pH ( NaCN)>pH(Na2CO3)>pH( CH3COONa) | |
| B. | 浓度均为0.2mol/L NaHCO3和 Na2CO3溶液中,存在的粒子种类不相同 | |
| C. | 0.4 mol•L-1HCN 溶液与 0.2 mol•L-1NaOH 溶液等体积混合后,所得溶液中:c(Na+)>c(OH-)>c(H+) | |
| D. | 25℃时,pH=4且浓度均为0.1 mol•L-1的 CH3COOH、CH3COONa混合溶液中:c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH) |
4. 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.下列有关a、b、c三点的说法中正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.下列有关a、b、c三点的说法中正确的是( )
 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.下列有关a、b、c三点的说法中正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.下列有关a、b、c三点的说法中正确的是( )| A. | 醋酸的电离程度由大到小的顺序:b>c>a | |
| B. | 溶液的pH由大到小的顺序:a>c>b | |
| C. | 用湿润的pH试纸测量醋酸溶液的pH,测量结果均偏大 | |
| D. | 溶液中$\frac{{c(C{H_3}COOH)}}{{c(C{H_3}CO{O^-})}}$的数值不变 |
1.硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题.
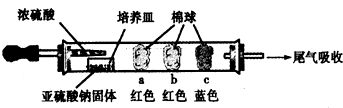
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.请填写表中的空白:
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验.图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置.
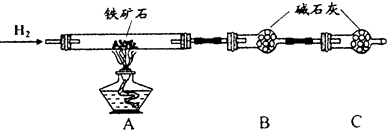
实验一:铁矿石中含氧量的测定
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为24%.
实验二:铁矿石中含铁量的测定
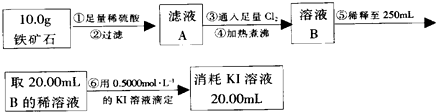
(1)步骤②和⑤中都要用到的玻璃仪器是烧杯、玻璃棒.
(2)下列有关步骤⑥的操作中说法不正确的是bc.
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为Fe5O6.
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.请填写表中的空白:

| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | SO2具有漂白性,且为暂时性漂白 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 该气体具有还原性 (选填“氧化性”或“还原性”) |

实验一:铁矿石中含氧量的测定
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为24%.
实验二:铁矿石中含铁量的测定

(1)步骤②和⑤中都要用到的玻璃仪器是烧杯、玻璃棒.
(2)下列有关步骤⑥的操作中说法不正确的是bc.
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为Fe5O6.
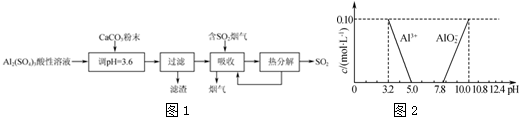
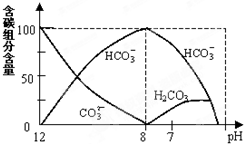 在含有弱电解质的溶液中,往往有多个化学平衡共存
在含有弱电解质的溶液中,往往有多个化学平衡共存