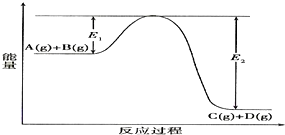
题目内容
1.硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题.Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.请填写表中的空白:
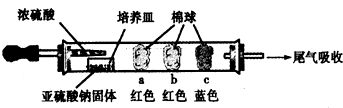
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | SO2具有漂白性,且为暂时性漂白 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 该气体具有还原性 (选填“氧化性”或“还原性”) |
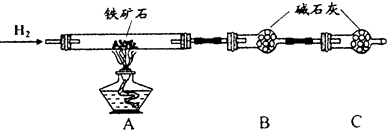
实验一:铁矿石中含氧量的测定
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为24%.
实验二:铁矿石中含铁量的测定
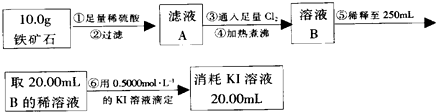
(1)步骤②和⑤中都要用到的玻璃仪器是烧杯、玻璃棒.
(2)下列有关步骤⑥的操作中说法不正确的是bc.
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为Fe5O6.
分析 I.a二氧化硫具有漂白性,但其漂白性不稳定,加热时会恢复为原来的颜色;
b.二氧化硫属于酸性氧化物,能和强碱反应生成盐和水;
c.二氧化硫具有还原性,能和碘发生氧化还原反应;
II.实验一:铁矿石中含氧量的测定
(3)在氢气还原金属氧化物时,在点燃酒精灯前要验纯;
(5)反应后装置B增重2.7g,即氢气和氧化铁反应后固体质量的增加值,可以根据差量法来计算;
实验二:(1)根据过滤、稀释液体和配制一定体积的溶液所选择的仪器来回答;
(2)根据滴定实验以及滴定过程中的实验误差分析知识判断;
根据碘元素计算铁元素的质量分数,再根据铁元素质量分数和氧元素质量分数计算出铁的氧化物的化学式.
解答 解:I.a.红色棉球变白,微热后又恢复红色,说明二氧化硫使品红溶液褪色,则棉球上滴有品红溶液,该实验说明二氧化硫具有漂白性,但其漂白性不稳定,
故填:品红溶液;二氧化硫具有漂白性,为暂时性漂白;
b.二氧化硫属于酸性氧化物,能和NaOH溶液反应生成亚硫酸钠和水或亚硫酸氢钠,导致溶液碱性减弱,所以棉球变为白色,离子方程式为:SO2+2OH-=SO32-+H2O或OHˉ+SO2=HSO3ˉ
故填:SO2+2OH-=SO32-+H2O或OHˉ+SO2=HSO3ˉ;
c.碘遇淀粉试液变蓝色,二氧化硫具有还原性,碘具有氧化性,二者反应生成氢碘酸和硫酸,所以棉球变为白色,离子方程式为:SO2+I2+2H2O=4H++SO42-+2I-,该实验说明二氧化硫具有还原性,
故填:含淀粉的碘水;还原性;
故答案为:
| 棉球 | 棉球上滴加的试剂 | 现象 | 解释和结论 |
| a | 品红试液 | SO2具有漂白性,且为暂时性漂白 | |
| b | 2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ | ||
| c | 含淀粉的碘水 | 还原性 |
(3)氢气中混有氧气时点燃会产生爆炸,为防止安全事故发生,待C装置出口处H2验纯后,点燃A处酒精灯,
故答案为:待C装置出口处H2验纯;
(5)测的反应后装置B增重2.70g,根据反应的实质,增加的是氧元素的质量,所以氧元素的质量分数是:$\frac{{\frac{2.70}{18}×16}}{10.0}$×100%=24%,
故答案为:24%;
实验二:(1)过滤需要的玻璃仪器有:烧杯、漏斗、玻璃棒,若稀释到250mL时采用的仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,则两个过程都需要的玻璃仪器有:烧杯、玻璃棒,
故答案为:烧杯、玻璃棒;
(2)a.滴定管用蒸馏水洗涤后再用待装液润洗,否则会导致测量结果偏大,故a正确;
b.锥形瓶不需要用待测液润洗,如果润洗,会导致测量结果偏大,故b错误;
c.碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故c错误;
故选bc;
由实验一,n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol
H2~H2O~O
0.15mol 0.15mol
由实验二,2Fe3++2I-=2Fe2++I2
Fe3+~~~I-
0.5×0.02 0.5×0.02
n(Fe3+)=0.5mol/L×0.25L=0.125mol
Fe3+~~~~Fe.
0.125mol 0.125mol
所以n(Fe):n(O)=0.125mol:0.15mol=5:6
铁的氧化物的化学式为:Fe5O6,
故答案为:bc;Fe5O6.
点评 本题考查了探究铁矿石中铁和氧元素的含量、二氧化硫的性质,二氧化硫具有还原性、氧化性、漂白性,根据二氧化硫的这几个性质分析解答;铁矿石中成分及其含量的测定中,根据物质的形成从整体上把握知识点,同时考查学生分析问题、解决问题的能力,题目难度中等.

| 实验原理 | m=cVM |
| 实验仪器 | 托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管 |
| 实验步骤 | (1)计算:溶质NaCl固体的质量为11.7g. (2)称量:用托盘天平称取所需NaCl固体. (3)溶解:将称好的NaCl固体放入烧杯中,用适量蒸馏水搅拌. (4)转移、洗涤:将烧杯中的溶液注入容量瓶中,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入容量瓶中. (5)定容:将蒸馏水注入仪器至液面离刻度线1~2cm时,改用 胶头滴管滴加蒸馏水至液面与刻度线相切. (6)摇匀:盖好瓶塞,反复上下颠倒,然后静置. |
| 思考与探究 | (7)某同学在实验步骤(6)后,发现凹液面低于刻度线,于是再向容器中滴加蒸馏水至刻度线,该同学所配置溶液是浓度< (填“>”、“=”或“<”)2.00mol/L. |
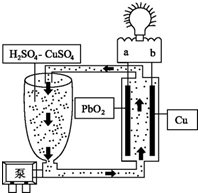 流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定.我国某研究小组新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )
流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定.我国某研究小组新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )| A. | a为正极,b为负极 | |
| B. | 该电池工作时PbO2电极附近溶液的pH增大 | |
| C. | b极的电极反应为Cu-2e-═Cu2+ | |
| D. | 调节电解质溶液的方法是补充CuSO4 |
 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.