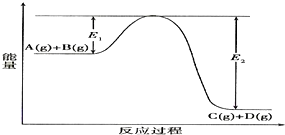
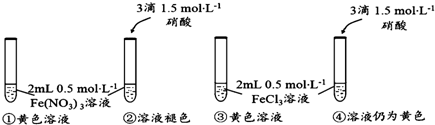
��Ŀ����
6�������������ơ���װ��ʹ�÷�������ѧ��ѧʵ��Ļ�������ͼΪ����ʵ��װ�ã�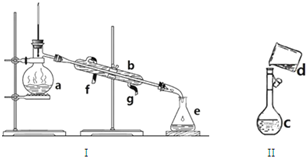
��1��д���������������ƣ�
a��������ƿ b�������� c������ƿ
��2������a��e�У�ʹ��ǰ�������Ƿ�©ˮ����c��������ţ�
��3��������װ��I�������Ȼ�̼�;ƾ��Ļ�����ȱ�ٵ������Ǿƾ��ƣ��������������������ʵ�飬�¶ȼ�ˮ�����λ����������ƿ֧�ܿڴ�������ˮ��g����f��g����ͨ�룬f��������
��4����������0.1mol/LNaOH��Һ450mL��װ��II��ijͬѧת����Һ��ʾ��ͼ��
��ͼ�еĴ�����δ�ò���������������ͼ�и����������ͷ�����ƽ�⣬Ϊ���ʵ�黹��Ҫ�������У�����������ͷ�ιܣ�
�ڸ��ݼ����֪������NaOH������Ϊ2.0g
������ʱ������ȷ�IJ���˳���ǣ�����ĸ��ʾ��ÿ����ĸֻ����һ�Σ�BCAFED��
A����30mLˮϴ���ձ�2��3�Σ�ϴ��Һ��ע������ƿ
B��ȷ��ȡ���������������ƹ������ձ��У��ټ�������ˮ��Լ30mL�����ò���������������ʹ�����ܽ�
C�����ܽ������������Һ�ز�����ע��500mL������ƿ��
D��������ƿ�ǽ�����ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�������
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�2��3cm����
���� ��1�����������Ľṹ�ص��жϣ�
��2���л����Ͳ�����������ʹ��ʱ�������Ƿ�©ˮ��
��3���������Ȼ�̼�;ƾ��Ļ��������þƾ��Ƽ��ȣ�ʵ����������̣��������¿��ǽ�ˮ�ڣ��Ͽ��dz�ˮ�ڣ�
��4����������һ�����ʵ���Ũ�ȵ���Һ�ķ����Ͳ�����Ѱ��װ���еĴ����ж�ʹ�������Ͳ������裮
��� �⣺��1��aΪ������ƿ��bΪ�����ܣ�cΪ����ƿ��
�ʴ�Ϊ��������ƿ�������ܣ�����ƿ��
��2������ƿ��ʹ��ǰҪ����Ƿ�©ˮ��������ƿ�������ܲ���Ҫ����Ƿ�©ˮ��
�ʴ�Ϊ��c��
��3���������Ȼ�̼�;ƾ��Ļ����������ķ������룬�����þƾ��ƣ��¶ȼ�Ӧλ��������ƿ֧�ܿڣ��������¿��ǽ�ˮ�ڣ��Ͽ��dz�ˮ�ڣ�
�ʴ�Ϊ���ƾ��ƣ�������ƿ֧�ܿڣ�g��f��
��3���ƾ��ƣ�������ƿ֧���ܿڴ��� g f
��4��������һ�����ʵ���Ũ�ȵ���Һ�DZ����ò�������������ֹҺ���⽦�����ҵ��μӵ���̶���1��2cmʱ���ý�ͷ�ιܵμ�Һ�壬
�ʴ�Ϊ��δ�ò���������������������ͷ�ιܣ�
��ʵ����û��450mL������ƿ��Ӧ����500mL������n��NaOH��=0.1mol/L��0.5L=0.05mol��m��NaOH��=0.05mol��40g/mol=2.0g��
�ʴ�Ϊ��2.0��
��������Һ5000mL�����Ʋ�������ȡ��ϡ�͡���Һ��ϴ����Һ�����ݡ�ҡ�ȵȲ�������������ƽ����2.0gNaOH�����ձ����ܽ⣬���ò��������裬��ȴ��ת�Ƶ�500mL����ƿ�У����ò�����������ϴ�ӣ�����ϴ��Һ��������ƿ������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�����ݵߵ�ҡ�ȣ����Բ���˳��ΪBCAFED��
�ʴ�Ϊ��BCAFED��
���� ���⿼�������ʵķ��롢һ����������������Һ�����ƣ���ʵ���������Ŀ��ͬѧ����ʵ�������Ҫ�ܹ���������Ӧ�ã���Ŀ�ѶȲ���

 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�| A�� | 18Oֻ��������������� | |
| B�� | 18O������������������������ | |
| C�� | 18Oֻ�������Ҵ������� | |
| D�� | 18O������ˮ����������� |

 CH3COOCH2CH3+H2O��������Ӧ��ȡ����Ӧ��
CH3COOCH2CH3+H2O��������Ӧ��ȡ����Ӧ��