��Ŀ����
11��ʵ������Na2CO3•10H2O���壬����0.2mol/L��Na2CO3��Һ480mL����1��ʵ�����õ��IJ�����������Ͳ���ձ�����ȱ_����������ͷ�ιܡ�500mL����ƿ��
��2��Ӧ��������ƽ��ȡNa2CO3•10H2O�ľ��������Ϊ28.6gg��
��3��������Һʱ�����¼���������
���ܽ� ��ҡ�� �� ��ϴ�ӡ� ����ȴ �ݳ����� ��ת����Һ �߶���
���������ߵľ�����̣�������ƿע������ˮ��ע�ⲻҪ�����̶ȣ�����̶�����2-3�����ǣ����ý�ͷ�ιܶ��ݣ��ζ�����Һ����̶�����ƽ�����ߵ�ҡ�ȣ�
��4���������в�����������Һ��Ũ�ȸ���ʲôӰ�죬�����գ�����ţ���
��̼����ʧȥ�˲��ֽᾧˮ�� ���á���������ij���������������
��̼���ƾ��岻�������л����Ȼ��� �ܳ���̼���ƾ���ʱ������������
������ƿδ�������ʹ�� ����Һ������ҡ�Ⱥ���Һ����ڿ̶���
��������������ҺŨ��ƫ�ߵ��Т٢ܣ���Ӱ����Тݣ�������ţ�
���� ��1���������Ʋ����Ǽ��㡢�������ܽ⡢��Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ��������Ҫ������������ʵ����������������������ã�
��2������n=cV��m=nM�����㣻
��3������ת�����úõ���Һ��ȥǡ��������ƿ�к���������ע������ˮ��ע�ⲻҪ�����̶ȣ�����̶�����2-3�����ǣ����ý�ͷ�ιܶ��ݣ��ζ�����Һ����̶�����ƽ�����ߵ�ҡ�ȣ�
��4������c=$\frac{n}{V}$�������������ʵ����ʵ��������Һ�������Ӱ���жϣ�
��� �⣺��1�����������м��㡢�������ܽ⡢��Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ����������ƽ��������ҩ��ȡ��ҩƷ�����ձ����ܽ⣨������Ͳ��ȡˮ�����ձ��������ò��������裬�����ܽ⣮��ȴ��ת�Ƶ�500mL����ƿ�У����ò�����������ϴ���ձ���������2-3�Σ�����ϴ��Һ��������ƿ�У���ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�����ݵߵ�ҡ�ȣ���������������������ƽ���ձ�����������500mL����ƿ����ͷ�ιܣ��ʻ�ȱ�ٲ���������ͷ�ιܡ�500mL����ƿ��
�ʴ�Ϊ������������ͷ�ιܡ�500mL����ƿ��
��2������0.2mol•L-1��Na2CO3��Һ500mL�������Na2CO3�����ʵ���n=cV=0.2mol/L��0.5L=0.1mol������Ҫ��Na2CO3•10H2O�����ʵ���Ϊ0.1mol������m=nM=0.1mol��286g/mol=28.6g��
�ʴ�Ϊ��28.6g��
��3������ת�����úõ���Һ��ȥǡ��������ƿ�к���������ע������ˮ��ע�ⲻҪ�����̶ȣ�����̶�����2-3�����ǣ����ý�ͷ�ιܶ��ݣ��ζ�����Һ����̶�����ƽ�����ߵ�ҡ�ȣ�
�ʴ�Ϊ��������ע������ˮ��ע�ⲻҪ�����̶ȣ�����̶�����2-3�����ǣ����ý�ͷ�ιܶ��ݣ��ζ�����Һ����̶�����ƽ�����ߵ�ҡ�ȣ�
��4����̼����ʧȥ�˲��ֽᾧˮ�����³������ʵ����������������ʵ����ʵ���ƫ��������Һ��Ũ��ƫ�ߣ��ʢ���ȷ����
���á���������ij��������������嵼�³������ʵ�����ƫС���������ʵ����ʵ���ƫС��������Һ��Ũ��ƫ�ͣ��ʢڴ���
��̼���ƾ��岻�������л����Ȼ��ƣ�����̼���Ƶ����ʵ���ƫС��������Һ��Ũ��ƫ�ͣ��ʢ۴���
�ܳ���̼���ƾ���ʱ�����������⣬���³������ʵ����������������ʵ����ʵ���ƫ��������Һ��Ũ��ƫ�ߣ��ʢ���ȷ����
������ƿδ�������ʹ�ò�Ӱ�����ʵ����ʵ�����Ҳ��Ӱ����Һ����������Զ����Ƶ���ҺŨ����Ӱ�죻
��ѡ���٢ܣ��ݣ�
���� ���⿼��һ�����ʵ���Ũ����Һ�����ƣ��״����Ǽ������ʵ��������ܶ�ͬѧ����Һ�������Ϊ��480mL�����³�������Ŀ�Ѷ��еȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | ʹʪ�����-KI��ֽ����ɫ�������Ϊ���� | |
| B�� | ����������״̬���Ȼ��Ʒ�Ӧ�ɲ������� | |
| C�� | ����ֽ��AgNO3���壬Ӧ�������ɫϸ���Լ�ƿ�� | |
| D�� | ��ˮӦ����ڽ�ͷ��ƿ����ɫ���� |
| A�� | ��0.1 mol/LһԪ��BOH��Һ��pH=10������֪��Һ����BOH=B++OH- | |
| B�� | ��������ˮ���ﵽ����ƽ���ˮϡ�ͣ�����Һ�е�c��OH-����С | |
| C�� | pH=3�Ĵ����ˮϡ�ͺ�CH3COOH����̶���������볣������ | |
| D�� | �����ڴ�������Һ�еĵ���̶ȴ��ڴ�ˮ�еĵ���̶� |
 �����£�CaSO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪Ksp��CaSO4��=9��10-6������˵������ȷ���ǣ�������
�����£�CaSO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪Ksp��CaSO4��=9��10-6������˵������ȷ���ǣ�������| A�� | a���Ӧ��Ksp����c���Ӧ��Ksp | B�� | ����Na2SO4��Һ����ʹa���Ϊb�� | ||
| C�� | a���Ϊb�㽫�г������� | D�� | d��δ�ﵽ�����ܽ�ƽ��״̬ |
| A�� | �к�ʱ����HCl���� | B�� | NH3•H2O�ĵ��볣�� | ||
| C�� | OH-�����ʵ��� | D�� | OH-��Ũ�� |
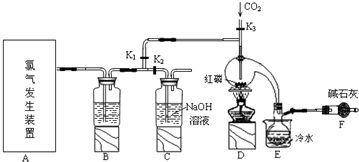
��֪������������Cl2��Ӧ����PCl3�������Cl2��Ӧ����PCl5��PCl3��O2������POCl3���������ף���POCl3����PCl3��PCl3��ˮ��ǿ��ˮ������H3PO3��HCl��PCl3��POCl3���۷е���±���
| ���� | �۵�/�� | �е�/�� |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
��1��д��A�з�Ӧ�����ӷ���ʽMnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O��
��2��Bװ������ʢ�Լ���Ũ���E���ձ�����ˮ������������PCl3��ֹ��ӷ������ռ���Ʒ��
��3�����װ�������Ժ���Dװ�õ�����ƿ�м�����ף���K3ͨ������CO2��һ��ʱ���ر�K3����������ƿ���ϲ��л�ɫ���������ʱͨ����������Ӧ�������У�����ͨ�����CO2��Ŀ�����ž�����ƿ�еĿ�������ֹPCl3��O2�ȷ�������Ӧ��
��4��ʵ���ƵõĴֲ�Ʒ�г�����POCl3��PCl5�ȣ���������ȳ�ȥPCl5����ͨ��������ʵ�����ƣ����ɵõ��ϴ�����PCl3��
��5��ʵ���ر�K1����K2����A��B��ʣ������ͨ��300ml 1mol/L��NaOH��Һ�У���NaOHǡ����ȫ��Ӧ�������跴Ӧ������NaCl��NaClO �� NaClO3 �����Σ�����Ӧ��ת�Ƶ��ӵ����ʵ�����n���ķ�Χ��0.15mol��n��0.25mol��
| A�� | ij���ȷ�Ӧ���Է����У���˸÷�Ӧ��������Ӧ | |
| B�� | ����NaHCO3ʹ��ˮ��Ư��������ǿ | |
| C�� | ���ܵ���ʿ������ܽ��С��ת��Ϊ�ܽ�ȸ�С�ģ������ܴ��ܽ��С��ת��Ϊ�ܽ�ȴ�� | |
| D�� | Kspֻ���¶ȵ�Ӱ�죬����Ũ�ȵ�Ӱ�� |