题目内容
11. 某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少.
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是反应放热,溶液温度升高,反应速率加快,t2~t3速率变化的主要原因是随反应进行,盐酸的浓度减小较大,反应速度减慢.
(2)实验②放出氢气的量减少的原因是Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少.
分析 (1)纯锌与稀盐酸反应,放出热量,速率加快,后期c(H+)起主导作用,随着反应进行c(H+)降低,反应速率减慢;
(2)锌片与FeCl3反应,导致与盐酸反应的锌的质量减少.
解答 解:(1)开始温度起主要作用,纯锌与稀盐酸反应,放出热量,温度升高,t1~t2速率加快;后期c(H+)起主导作用,随着反应进行c(H+)降低,t2~t3反应速率减慢,
故答案为:反应放热,溶液温度升高,反应速率加快;随反应进行,盐酸的浓度减小较大,反应速度减慢;
(2)锌片与FeCl3反应,导致与盐酸反应的锌的质量减少,生成氢气量减少,
故答案为:Fe3+氧化性大于H+,所以锌先与Fe3+反应,故氢气量减少.
点评 本题考查探究影响化学反应速率的因素,题目难度中等,侧重考查学生对知识的迁移运用,涉及外界条件对反应速率的影响,本题难度中等.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
1.在一密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g).已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol•L-1、0.1mol•L-1、0.2mol•L-1.当反应达到平衡时,可能存在的数据是( )
| A. | SO2为0.4 mol•L-1,O2为0.2 mol•L-1 | |
| B. | SO2为0.2 mol•L-1 | |
| C. | SO2、SO3分别为0.15 mol•L-1、0.3 mol•L-1 | |
| D. | SO3为0.4 mol•L-1 |
2.下列分子为极性分子的是( )
| A. | BF3 | B. | NH3 | C. | SO3 | D. | CS2 |
19.燃料电池是一种新型电池.某氢氧燃料电池的基本反应是:X极:O2(g)+2H2O(l)+4e-=4OH-Y极:2H2(g)-4e-+4OH-=4H2O(l)下列判断正确的是( )
| A. | 该电池的电解质溶液为酸性 | B. | 电池总反应为2H2+O2=2H2O | ||
| C. | X极是负极,发生氧化反应 | D. | 电池工作一段时间后溶液PH增大 |
6.能用H++OH-=H2O表示的是( )
| A. | NH3•H2O+HNO3→NH4NO3+H2O | B. | CH3COOH+KOH→CH3COOK+H2O | ||
| C. | H2SO4+Ba(OH)2→BaSO4↓+2H2O | D. | 2HCl+Ca(OH)2→CaCl2+2H2O |
16.通过以下反应均可获取H2.下列有关说法不正确的是( )
①太阳光催化分解水制氢:2H2O(1)═2H2(g)+O2(g)△H1=+571.6kJ/mol
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=+131.3kJ/mol
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.1kJ/mol( )
①太阳光催化分解水制氢:2H2O(1)═2H2(g)+O2(g)△H1=+571.6kJ/mol
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=+131.3kJ/mol
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.1kJ/mol( )
| A. | 由反应①知H2的燃烧热为571.6kJ/mol | |
| B. | 反应②中生成物的总能量高于反应物的总能量 | |
| C. | 反应③若改用新催化剂,△H3不变化 | |
| D. | 反应CH4(g)═C(s)+2H2(g)的△H=+74.8kJ/mol |
3.下列有关元素的性质及其递变规律正确的是( )
| A. | 核外电子排布相同的微粒化学性质相同 | |
| B. | 非金属的气态氢化物的稳定性越强其沸点就越高 | |
| C. | 同主族元素形成的单质熔、沸点随元素核电荷数的递增而逐渐降低 | |
| D. | 同主族非金属元素最高价氧化物对应水化物的酸性随核电荷数的增加而减弱 |
15.溶质都为1mol的NaHCO3溶液和Ba(OH)2溶液混合,能完整表示该反应的离子方程式是( )
| A. | CO32-+Ba2+=BaCO3 | |
| B. | HCO3-+OH-→H2O+CO32- | |
| C. | HCO3-+Ba2++OH-→H2O+BaCO3 | |
| D. | 2HCO3-+Ba2++OH-=BaCO3+2H2O+CO32- |
16.下列操作或装置能达到实验目的是( )
| A. | 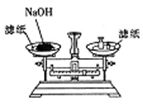 称取一定的NaOH | |
| B. | 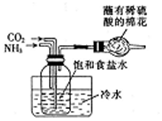 制取Na2CO3 | |
| C. | 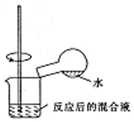 检验浓硫酸与铜反应后的产物中是否含有铜离子 | |
| D. | 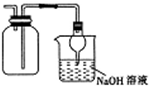 收集NO2并防止其污染环境 |