题目内容
3.下列有关元素的性质及其递变规律正确的是( )| A. | 核外电子排布相同的微粒化学性质相同 | |
| B. | 非金属的气态氢化物的稳定性越强其沸点就越高 | |
| C. | 同主族元素形成的单质熔、沸点随元素核电荷数的递增而逐渐降低 | |
| D. | 同主族非金属元素最高价氧化物对应水化物的酸性随核电荷数的增加而减弱 |
分析 A.核外电子排布相同的微粒化学性质不一定相同,如S2-、Ar、K+;
B.非金属的稳定性与其沸点没有必然关系;
C.同主族元素形成的单质的熔、沸点,金属单质随元素核电荷数的递增而逐渐降低,非金属单质逐渐升高;
D.同一主族,原子序数越大,非金属性越弱,其最高价氧化物对应水合物的酸性越弱.
解答 解:A.核外电子排布相同的微粒化学性质不一定相同,如S2-、Ar、K+,若互为同位素原子时化学性质相同,故A错误;
B.非金属的气态氢化物的稳定性越强,其非金属性越强,但其沸点不一定高,故B错误;
C.同主族元素形成的单质熔、沸点随元素核电荷数的递增不一定逐渐降低,如非金属元素单质沸点逐渐升高,故C错误;
D.同主族非金属元素最高价氧化物对应水化物的酸性取决于非金属性强弱,随核电荷数的增加非金属性逐渐减弱,则最高价含氧酸的酸性逐渐减弱,故D正确;
故选D.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,明确元素周期律的内容为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
13.下列物质属于原子晶体的是( )
| A. | HCl | B. | He | C. | Si | D. | NaCl |
14.下列物质中含有非极性键的分子是( )
| A. | CaF2 | B. | H2O2 | C. | CO2 | D. | NaOH |
18.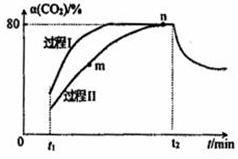 一定条件下,CO2(g)+3H2(g)?H2O(g)+CH3OH(g)△H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线.下列说法不正确的是( )
一定条件下,CO2(g)+3H2(g)?H2O(g)+CH3OH(g)△H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线.下列说法不正确的是( )
 一定条件下,CO2(g)+3H2(g)?H2O(g)+CH3OH(g)△H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线.下列说法不正确的是( )
一定条件下,CO2(g)+3H2(g)?H2O(g)+CH3OH(g)△H=-53.7kJ/mol;向2L 恒容恒温密闭容器中充入1mol CO2和2.8molH2反应,图中过程I、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线.下列说法不正确的是( )| A. | m点:v(正)>v(逆) | |
| B. | 活化能:过程Ⅱ>过程I | |
| C. | n点时该反应的平衡常数K=50 | |
| D. | 过程I,t2时刻改变的反应条件可能是升高温度 |
3.一定条件下,对于可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3 (均不为零),平衡时 X、Y、Z 的浓度分别为 0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的( )
| A. | c1:c2=3:1 | |
| B. | 平衡时.Y和Z的生成速率之比为2:3 | |
| C. | X、Y的转化率不相等 | |
| D. | c1 的取值范围为 0 mol/L<c1<0.14 mol/L |
7.W、X、Y、Z均是短周期元素,X、Y、Z处于同一周期,W、X、Z的简单离子具有相同的电子层结构,W的最高氧化物的水化物可与其最简单的气态氢化物反应生成易溶于水的盐,X的氧化物具有两性,Y的最高正价与最低负价的代数和为0,下列说法正确的是( )
| A. | 离子半径:W>Z>X | |
| B. | 单质熔点:W>Z | |
| C. | 最高正价:W>X>Y>Z | |
| D. | W、X、Z最高价氧化物对应的水化物相互之间能发生反应 |
8.下列符合元素周期律的是( )
| A. | 碱性:Ca(OH)2>Mg(OH)2 | B. | 酸性:H2SO3>H2CO3 | ||
| C. | 热稳定性:NH3<PH3 | D. | 还原性:S2-<Cl- |
 某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验: 铜和稀硝酸反应时,会出现奇妙的速率变化,开始时二者的反应速率非常慢,但随着反应的进行,反应速率却逐渐明显加快.对于上述变化的原因,课外活动小组同学进行了实验探究.
铜和稀硝酸反应时,会出现奇妙的速率变化,开始时二者的反应速率非常慢,但随着反应的进行,反应速率却逐渐明显加快.对于上述变化的原因,课外活动小组同学进行了实验探究.