题目内容
16.通过以下反应均可获取H2.下列有关说法不正确的是( )①太阳光催化分解水制氢:2H2O(1)═2H2(g)+O2(g)△H1=+571.6kJ/mol
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=+131.3kJ/mol
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.1kJ/mol( )
| A. | 由反应①知H2的燃烧热为571.6kJ/mol | |
| B. | 反应②中生成物的总能量高于反应物的总能量 | |
| C. | 反应③若改用新催化剂,△H3不变化 | |
| D. | 反应CH4(g)═C(s)+2H2(g)的△H=+74.8kJ/mol |
分析 A.燃烧热是1mol可燃物质完全燃烧生成稳定氧化物放出的热量;
B.△H2>0,反应为吸热反应;
C.催化剂不能改变反应热的大小;
D.根据盖斯定律,目标反应CH4(g)═C(s)+2H2(g)相当于③-②.
解答 解:A.2H2O(1)═2H2(g)+O2(g)△H1=+571.6kJ/mol,则2molH2完全燃烧生成液态水放出的热量为571.6kJ,所以氢气的燃烧热是285.8kJ/mol,故A错误;
B.反应的△H2>0,故该反应为吸热反应,生成物的总能量高于反应物的总能量,故B正确;
C.催化剂降低反应所需的能量,不改变反应热的大小,故C正确;
D.根据盖斯定律,目标反应CH4(g)═C(s)+2H2(g)相当于③-②,故△H=△H3-△H2,△H=206.1kJ•mol-1-131.3kJ•mol-1=74.8kJ•mol-1,故D正确;
故选A.
点评 本题考查了化学反应与能量变化,利用盖斯定律进行相关计算,注意催化剂不能改变焓变,盖斯定律计算时焓变的加减时正负号为易错点,题目难度不大.

练习册系列答案
相关题目
4.乙醇转化为乙醛,发生的反应为( )
| A. | 取代反应 | B. | 加成反应 | C. | 消除反应 | D. | 氧化反应 |
1.下列做法中科学,合理的是( )
| A. | 充分利用太阳能,进行海水淡化 | |
| B. | 将秸秆露天焚烧,从而充分利用生物质能 | |
| C. | 以二氧化硅为光电池材料,将太阳能转化为电能 | |
| D. | 用甲烷与水作用生产清洁能源--H2,该过程的原子利用率为100% |
3.一定条件下,对于可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3 (均不为零),平衡时 X、Y、Z 的浓度分别为 0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的( )
| A. | c1:c2=3:1 | |
| B. | 平衡时.Y和Z的生成速率之比为2:3 | |
| C. | X、Y的转化率不相等 | |
| D. | c1 的取值范围为 0 mol/L<c1<0.14 mol/L |
20.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时,0.1mol/LX和W形成化合物的水溶液pH=1.下列说法正确的是( )
| A. | Z与Y、Z与W形成的化合物的化学键完全相同 | |
| B. | X与Y组成的简单氢化物的沸点高于X与R组成的简单氢化物的沸点,是因为非金属性Y>R | |
| C. | 简单离子的半径:Z>R>W>Y | |
| D. | Y、Z、W三种元素组成的化合物的水溶液可能显碱性 |
 某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验: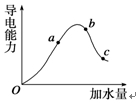 一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题:
一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题: