题目内容
16.下列操作或装置能达到实验目的是( )| A. | 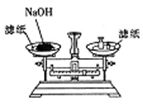 称取一定的NaOH | |
| B. | 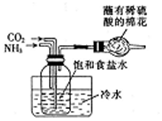 制取Na2CO3 | |
| C. | 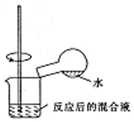 检验浓硫酸与铜反应后的产物中是否含有铜离子 | |
| D. | 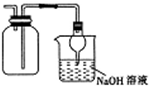 收集NO2并防止其污染环境 |
分析 A.NaOH潮解后具有腐蚀性;
B.氨气、二氧化碳、氯化钠溶液反应生成碳酸氢钠,相同条件下碳酸氢钠的溶解度小;
C.应将密度大的液体注入密度小的液体中;
D.二氧化氮的密度比水大,碱溶液可吸收.
解答 解:A.NaOH潮解后具有腐蚀性,则应在左盘小烧杯中称量,故A错误;
B.NaCl、氨气、二氧化碳反应生成碳酸氢钠和氯化铵,图中装置可制备碳酸氢钠,碳酸氢钠分解生成碳酸钠,过量氨气利用稀硫酸吸收,故B正确;
C.稀释时将密度大的液体注入密度小的液体中,试剂的顺序不合理,故C错误;
D.二氧化氮的密度比空气密度大,则图中导管应长进,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握图中实验装置的作用、物质的制备、气体的收集、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
7.W、X、Y、Z均是短周期元素,X、Y、Z处于同一周期,W、X、Z的简单离子具有相同的电子层结构,W的最高氧化物的水化物可与其最简单的气态氢化物反应生成易溶于水的盐,X的氧化物具有两性,Y的最高正价与最低负价的代数和为0,下列说法正确的是( )
| A. | 离子半径:W>Z>X | |
| B. | 单质熔点:W>Z | |
| C. | 最高正价:W>X>Y>Z | |
| D. | W、X、Z最高价氧化物对应的水化物相互之间能发生反应 |
11.下列相关数值判断正确的是( )
| A. | 常温下,pH=2的硫酸溶液中,由水电离出的H+个数为10-12NA | |
| B. | 标准状况下,1.12L二氯甲烷含氯离子数为0.2NA | |
| C. | 向过量FeI2溶液中通入Cl2,当有1mol Fe2+被氧化时,转移的电子数为3NA | |
| D. | 2molNH3与3molO2在催化剂作用下加热充分反应后,所得NO分子数小于2NA |
8.下列符合元素周期律的是( )
| A. | 碱性:Ca(OH)2>Mg(OH)2 | B. | 酸性:H2SO3>H2CO3 | ||
| C. | 热稳定性:NH3<PH3 | D. | 还原性:S2-<Cl- |
5.X、Y、Z、W为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如表所示,用化学用语回答下列问题.
请按要求回答下列问题:
(1)工业上制取X的单质的化学方程式:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
(2)X、Y、W三种元素对应的离子半径由大到小的顺序为:Cl->Mg2+>Al3+.
(3)在25℃、101kPa下,已知13.5g的Y的固体单质在W的气体单质中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是2Al(s)+3Cl2(g)=2AlCl3(s)△H=-1676kJ/mol.
(4)甲中各原子都满足8电子稳定结构,其电子式为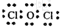 ;
;
(5)Sn与元素Z同主族,周期数比元素Z的大2.则Sn的原子序数为50;已知锡在水溶液中有Sn2+、Sn4+两种存在形式,且硫酸盐均可溶.酸性条件下,SnSO4可用作双氧水的去除剂,试写出所发生反应的离子方程式:Sn2++H2O2+2H+═Sn4++2H2O.潮湿环境中,镀锡铜如果锡层破损不能(填“能”或“不能”)形成铜绿.
| 元素 | X | Y | Z | W |
| 性质 结构 信息 | 工业上常用电解熔融XW2制取X的单质. | Y的最外层电子数比最内层电子数多1. | Z的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂. | W的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强. |
(1)工业上制取X的单质的化学方程式:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
(2)X、Y、W三种元素对应的离子半径由大到小的顺序为:Cl->Mg2+>Al3+.
(3)在25℃、101kPa下,已知13.5g的Y的固体单质在W的气体单质中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是2Al(s)+3Cl2(g)=2AlCl3(s)△H=-1676kJ/mol.
(4)甲中各原子都满足8电子稳定结构,其电子式为
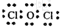 ;
;(5)Sn与元素Z同主族,周期数比元素Z的大2.则Sn的原子序数为50;已知锡在水溶液中有Sn2+、Sn4+两种存在形式,且硫酸盐均可溶.酸性条件下,SnSO4可用作双氧水的去除剂,试写出所发生反应的离子方程式:Sn2++H2O2+2H+═Sn4++2H2O.潮湿环境中,镀锡铜如果锡层破损不能(填“能”或“不能”)形成铜绿.
18. 石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )
石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )
 石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )
石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )| A. | 放电时,锂在负极上发生氧化反应 | |
| B. | 放电时,正极的电极反应式为nS+2e-+2Li+=Li2Sn | |
| C. | 充电时,锂电极为阴极,与电源负极相连 | |
| D. | 充电时,理论上阳极失去2mol电子生成32g硫 |
 某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验: A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大.A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一.请化学用语回答下列问题:
A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大.A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一.请化学用语回答下列问题: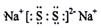 ,写出在空气中长期放置生成H的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2.H的溶液与稀硫酸反应产生的现象为溶液由黄色变为无色,产生浅黄色沉淀和气体产生.
,写出在空气中长期放置生成H的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2.H的溶液与稀硫酸反应产生的现象为溶液由黄色变为无色,产生浅黄色沉淀和气体产生.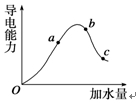 一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题:
一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题: