题目内容
1.在一密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g).已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol•L-1、0.1mol•L-1、0.2mol•L-1.当反应达到平衡时,可能存在的数据是( )| A. | SO2为0.4 mol•L-1,O2为0.2 mol•L-1 | |
| B. | SO2为0.2 mol•L-1 | |
| C. | SO2、SO3分别为0.15 mol•L-1、0.3 mol•L-1 | |
| D. | SO3为0.4 mol•L-1 |
分析 化学平衡研究的对象为可逆反应.化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:A.SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度变化分别为0.2mol/L、0.1mol/L,因可逆反应,实际变化应小于该值,所以SO2小于 0.4mol/L,O2小于0.2mol/L,故A错误;
B.SO2为0.2 mol•L-1小于0.4mol/L,故B正确;
C.SO2、SO3分别为0.15 mol•L-1、0.3 mol•L-1,硫元素不守恒,故C错误;
D.SO3的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度的浓度变化为0.2mol/L,实际变化小于该值,故D错误;
故选B.
点评 本题考查了化学平衡的建立,关键是利用可逆反应的不完全性,运用极限假设法解答,题目不难.

练习册系列答案
相关题目
12.用下列装置在实验室中进行二氧化硫的制取、检验、收集和尾气处理,不能达到相应实验目的是( )
| A. | 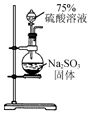 用装置制取二氧化硫 | B. | 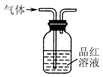 用装置检验二氧化硫的漂白性 | ||
| C. | 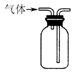 用装置收集二氧化硫 | D. | 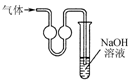 用装置进行尾气处理 |
9.下列有关化学用语说法正确的( )
| A. | 过氧化氢的电子式: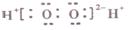 | |
| B. | 比例模型  既可以表示甲烷分子,也可以表示四氯化碳分子 既可以表示甲烷分子,也可以表示四氯化碳分子 | |
| C. | 次氯酸的结构式H-O-Cl | |
| D. | 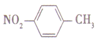 表示对硝基甲苯的结构简式 表示对硝基甲苯的结构简式 |
16.下列与化学有关说法中正确的是( )
| A. | ${\;}_{53}^{127}$I和${\;}_{53}^{131}$I2互为同位素 | |
| B. | lmol碳酸钾晶体中含阴离子数为等于NA个 | |
| C. | 分子式为C4H8O2的羧酸共有3种 | |
| D. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O |
13.下列物质属于原子晶体的是( )
| A. | HCl | B. | He | C. | Si | D. | NaCl |

 某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验: