题目内容
达平衡状态的可逆反应:N2(g)+3H2(g)?2NH3(g),改变某一条件,一段时间后,测得正反应速率以N2的浓度减小表示:v(N2)=0.6mol/(L?min),逆反应速率以NH3的浓度减小表示:v(NH3)=1.2mol/(L?min),此时可逆反应的状态是( )
| A、测定时,v正>v逆 |
| B、测定时,v正<v逆 |
| C、测定时,v正=v逆 |
| D、不可能达到新平衡 |
考点:反应速率的定量表示方法
专题:化学平衡专题
分析:依据化学反应速率之比等于反应速率之比,表示的是正反应速率之比,若物质的正逆反应速率相同说明反应达到平衡状态,v正<v逆 ,反应逆向进行,v正>v逆反应正向进行.
解答:
解:v正(N2)表示消耗N2的速率,v逆(NH3)表示消耗NH3的速率,且v正(N2):v逆(NH3)=1:2,充分说明向两个相反方向进行的程度相当,说明到达平衡状态,
故选C.
故选C.
点评:本题考查化学平衡状态的判断,题目难度不大,本题注意把握平衡状态的实质以及判断的依据.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
一定量的锎(
Cf)是有用的中子源,在医学上常用作治疗恶性肿瘤的中子源.下列有关锎的说法错误的是( )
252 98 |
A、
| ||
B、
| ||
C、
| ||
| D、锎元素位于第6周期 |
叠氮化钠(NaN3)是无色离子晶体,遇高热或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一.下列有关说法正确的是( )
| A、NaN3中只含有离子键 |
| B、1mol NaN3完全分解最多可以产生33.6L N2 |
| C、当有4.2g N2生成时,转移电子数约为6.02×1022 |
| D、常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项 |
工业上用金红石(主要成分TiO2)制金属钛可通过以下反应进行:
①TiO2+2C+2Cl2
TiCl4+2CO ②TiCl4+2Mg
Ti+2MgCl2
对于上述两个反应的叙述正确的是( )
①TiO2+2C+2Cl2
| ||
| ||
| 加热 |
对于上述两个反应的叙述正确的是( )
| A、都是置换反应 |
| B、都是氧化还原反应 |
| C、反应中钛元素都被还原 |
| D、加热时金属钛和氩气(Ar)能反应 |
下列说法正确的是( )
| A、电子层数越多,原子半径一定越大 | ||||
B、已知2C+SiO2
| ||||
| C、第ⅥA族元素的氢化物中,稳定性最强的其沸点最低 | ||||
| D、按照元素周期表的排布规律,非金属元素最多为23种 |
铊是超导材料的组成元素之一,铊在元素周期表中位于第六周期,与铝是同主族元素,元素符号是Tl.以下对铊的单质及其化合物的性质推断中,不正确的是( )
| A、铊是易导电的银白色金属 |
| B、铊能生成+3价的离子 |
| C、Tl3+的氧化能力比Al3+强 |
| D、氢氧化铊的碱性比氢氧化铝强 |
在合成氨工业中,实现下列目的变化过程中与平衡移动无关的是( )
| A、为增加NH3的日产量,不断将NH3分离出来 |
| B、为增加NH3的日产量,使用催化剂 |
| C、为增加NH3的日产量,采用500℃左右的高温 |
| D、为增加NH3的日产量,采用2×107-5×107Pa的压强 |
香叶醛分子的结构简式如图所示.下列叙述正确的是( )
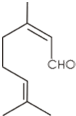

| A、1 mol香叶醛发生加成反应需要2 mol H2 |
| B、香叶醛不能与溴发生反应 |
| C、香叶醛能与钠发生反应生成H2 |
| D、香叶醛能发生银镜反应 |