题目内容
下列说法正确的是( )
| A、电子层数越多,原子半径一定越大 | ||||
B、已知2C+SiO2
| ||||
| C、第ⅥA族元素的氢化物中,稳定性最强的其沸点最低 | ||||
| D、按照元素周期表的排布规律,非金属元素最多为23种 |
考点:元素周期表的结构及其应用,非金属在元素周期表中的位置及其性质递变的规律,元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:A.电子层数只是影响原子半径的一个因素;
B.非金属性越强,对应的单质的氧化性越强,还原性越弱;
C.第ⅥA族元素的氢化物中,稳定性最强为水,含有氢键;
D.按照元素周期表的排布规律,非金属元素在周期表中的数目以此为2、6、5、4、3、2、1.
B.非金属性越强,对应的单质的氧化性越强,还原性越弱;
C.第ⅥA族元素的氢化物中,稳定性最强为水,含有氢键;
D.按照元素周期表的排布规律,非金属元素在周期表中的数目以此为2、6、5、4、3、2、1.
解答:
解:A.电子层数只是影响原子半径的一个因素,还要考虑核对电子的吸引,核外电子多,相应的核内质子数也多,由于静电力的增强可能会引起原子半径的减小,图Li>Cl,故A错误;
B.非金属性越强,对应的单质的氧化性越强,还原性越弱,非金属性C>Si,故B错误;
C.第ⅥA族元素的氢化物中,稳定性最强为水,含有氢键,沸点最高,故C错误;
D.按照元素周期表的排布规律,非金属元素在周期表中的数目以此为2、6、5、4、3、2、1,共23种,故D正确.
故选D.
B.非金属性越强,对应的单质的氧化性越强,还原性越弱,非金属性C>Si,故B错误;
C.第ⅥA族元素的氢化物中,稳定性最强为水,含有氢键,沸点最高,故C错误;
D.按照元素周期表的排布规律,非金属元素在周期表中的数目以此为2、6、5、4、3、2、1,共23种,故D正确.
故选D.
点评:本题综合考查元素周期表、元素周期律知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
弱电解质区别于强电解质的理论根据是( )
| A、溶液的导电性差 |
| B、在溶液中离子与离子间存在电离平衡 |
| C、溶解度小 |
| D、在溶液中存在分子和离子之间的电离平衡 |
滴有酚酞和氯化钠试液的湿润滤纸分别做甲乙两个实验,能发现附近变成红色的电极是( )


| A、a、c | B、b、d |
| C、a、d | D、b、c |
H2SO3水溶液中存在电离平衡H2SO3?H++HSO3-和HSO3-?H++SO32-,若向H2SO3溶液中( )
| A、通入氯气,溶液中氢离子浓度增大 |
| B、通入过量H2S,反应后溶液pH减小 |
| C、加入氢氧化钠溶液,平衡向右移动,pH变小 |
| D、加入氯化钡溶液,平衡向右移动,会产生亚硫酸钡沉淀 |
下列电离方程式书写正确的是( )
| A、HS-在水溶液中的电离方程式:HS-+H2O?H3O++S2- | ||
B、H3PO4在水溶液中的电离方程式:H3PO4?3H++P
| ||
| C、NaHSO4在水溶液中的电离方程式:NaHSO4=Na++HSO4- | ||
| D、CaCO3在水溶液中的电离方程式:CaCO3?Ca2++CO32- |
达平衡状态的可逆反应:N2(g)+3H2(g)?2NH3(g),改变某一条件,一段时间后,测得正反应速率以N2的浓度减小表示:v(N2)=0.6mol/(L?min),逆反应速率以NH3的浓度减小表示:v(NH3)=1.2mol/(L?min),此时可逆反应的状态是( )
| A、测定时,v正>v逆 |
| B、测定时,v正<v逆 |
| C、测定时,v正=v逆 |
| D、不可能达到新平衡 |
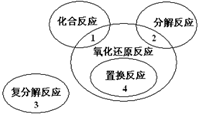 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于1区的是( )
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于1区的是( )| A、Cl2+2KBr═Br2+2KCl |
| B、2NaHCO3═Na2CO3+H2O+CO2 |
| C、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
| D、2Na2O2+2CO2═2Na2CO3+O2 |
25℃时,水的电离达到平衡;H2O?H-+OH-△H>0,下列叙述正确的是( )
| A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B、向水中加入少量固体硫酸氢钠,c(H-)降低 |
| C、向水中加入少量固体氢氧化钠,平衡正向移动,c(H-)降低 |
| D、将水加热,KW增大,pH不变 |
