题目内容
7.下列各反应的离子方程式中,错误的是( )| A. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 过量铁片放入稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 大理石与稀盐酸反应:CaCO3+2H+═CO2↑+H2O+Ca2+ | |
| D. | 氢氧化钙溶液中通入过量CO2:OH-+CO2═HCO3- |
分析 A.二者反应生成硫酸铵和氢氧化铝;
B.铁片过量,反应生成二价铁离子;
C.碳酸钙与盐酸反应生成氯化钙和水、二氧化碳;
D.二氧化碳过量反应生成碳酸氢钙.
解答 解:A.硫酸铝溶液中加入过量的氨水,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A正确;
B.过量铁片放入稀硝酸中,离子方程式:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故B错误;
C.大理石与稀盐酸反应,离子方程式:CaCO3+2H+═CO2↑+H2O+Ca2+,故C正确;
D.氢氧化钙溶液中通入过量CO2,离子方程式:OH-+CO2═HCO3-,故D正确;
故选:B.
点评 本题考查了离子方程式的正误判断,掌握离子方程式的书写原则,明确离子方程式正误判断常用方法是解题关键,题目难度不大.

练习册系列答案
相关题目
16.下列元素-定为主族元素的是( )
| A. | 其原子最外电子层有7个电子的元素 | |
| B. | 最高正价为+3的元素 | |
| C. | 其原子最外层电子数大于电子层的元素 | |
| D. | 最高价氧化物对应的水化物是酸的元素 |
2.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA | |
| B. | NA个D2O分子中,含有10NA个电子 | |
| C. | 117克氯化钠固体中,含有2NA个氯化钠分子 | |
| D. | 32克SO2与足量的O2反应转移的电子数为NA |
12.某溶液中在25℃时由水电离出的氢离子浓度1×10-13 mol•L-1,下列说法正确的是( )
| A. | HCO3-离子在该溶液中一定不能大量共存 | |
| B. | 该溶液的pH一定是13 | |
| C. | 向该溶液中加入铝片后,一定能生成氢气 | |
| D. | 若该溶液的溶质只有一种,它一定是酸或碱 |
16.X~R是元素周期表中的短周期元素,其性质或结构信息如表:
请回答下列问题:
(1)X在元素周期表中的位置是第三周期ⅦA族
(2)元素W的离子结构示意图为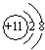
(3)元素R的最高价氧化物的电子式为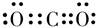
(4)X的氢化物和Z的氢化物反应形成化合物A,A中含有的化学键类型为离子键、极性键
(5)含Y的某化合物的水溶液呈酸性,可净水.起净水作用的物质为Al(OH)3胶体
(6)W的氢氧化物是重要的基本化工原料.
工业上用电解饱和NaCl溶液制取该氢氧化物,生产中副产物有C12、H2 (写化学式)
| 元素 | X | Y | Z | W | R |
| 性质信息 | 能形成+7价的化合物 | 日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 | 通常状况下能形成短周期中最稳定的双原子分子 | 焰色反应为黄色 | 位于第IVA,是形成化合物种类最多的元素 |
(1)X在元素周期表中的位置是第三周期ⅦA族
(2)元素W的离子结构示意图为
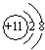
(3)元素R的最高价氧化物的电子式为
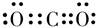
(4)X的氢化物和Z的氢化物反应形成化合物A,A中含有的化学键类型为离子键、极性键
(5)含Y的某化合物的水溶液呈酸性,可净水.起净水作用的物质为Al(OH)3胶体
(6)W的氢氧化物是重要的基本化工原料.
工业上用电解饱和NaCl溶液制取该氢氧化物,生产中副产物有C12、H2 (写化学式)
17.如表对物质的用途及解释都正确的是( )
| 选项 | 物质 | 用途 | 解释 |
| A | SO2 | 食品漂白剂 | SO2具有还原性 |
| B | NaClO | 消毒剂 | NaClO具有强氧化性,能杀灭细菌 |
| C | Na2CO3 | 中和过多胃酸 | Na2CO3属于碱 |
| D | 浓硫酸 | 干燥剂 | 浓硫酸具有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
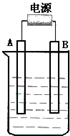 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题: