题目内容
19.按要求写出化学方程式或离子方程式:(1)乙酸乙酯和氢氧化钠溶液共热的化学方程式CH3COOC2H5+NaOH$\stackrel{△}{→}$CH3COONa+C2H5OH.
(2)工业制粗硅的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)偏铝酸钠溶液中通入过量二氧化碳的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
分析 (1)乙酸乙酯与氢氧化钠溶液共热会发生酯的水解反应;
(2)C还原二氧化硅制粗硅;
(3)向偏铝酸钠溶液中通入过量的二氧化碳气体生成氢氧化铝和碳酸氢钠;
解答 解:(1)乙酸乙酯与氢氧化钠溶液共热会发生酯的水解反应生成乙酸钠和乙醇,发生反应的方程式为:CH3COOC2H5+NaOH$\stackrel{△}{→}$CH3COONa+C2H5OH,
故答案为:CH3COOC2H5+NaOH$\stackrel{△}{→}$CH3COONa+C2H5OH;
(2)C还原二氧化硅制粗硅,化学反应为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(3)向偏铝酸钠溶液中通入过量的二氧化碳气体生成氢氧化铝和碳酸氢钠,离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
点评 本题考查了化学方程式的书写,题目难度中等,在解此类方程式的书写题时,首先确定反应原理,然后再依据原理找出反应物、生成物和反应条件,根据方程式的书写规则书写方程式,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列有关金属的说法中,正确的是( )
①在人类对金属材料的使用过程中,性质活泼的金属单质最早被人们冶炼和使用
②生铁的熔点比纯铁低,硬度比纯铁大
③单质铝在空气中比较耐腐蚀,所以铝是不活泼金属
④正常人体缺钙会引起骨质疏松症,缺铁会引起贫血等疾病
⑤青铜、不锈钢、硬铝都是合金
⑥可通过焰色反应区分钾元素和钠元素.
①在人类对金属材料的使用过程中,性质活泼的金属单质最早被人们冶炼和使用
②生铁的熔点比纯铁低,硬度比纯铁大
③单质铝在空气中比较耐腐蚀,所以铝是不活泼金属
④正常人体缺钙会引起骨质疏松症,缺铁会引起贫血等疾病
⑤青铜、不锈钢、硬铝都是合金
⑥可通过焰色反应区分钾元素和钠元素.
| A. | ②④⑤⑥ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②⑤⑥ |
10.根据下列有关图象,说法正确的是( )


| A. | 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 已知图Ⅱ△H<0,由图Ⅱ知,t3时采取的措施是降低反应体系温度 | |
| C. | 由图Ⅱ知,反应在t6时,NH3体积分数最大 | |
| D. | Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出5.16kJ的热量 |
7.下列各反应的离子方程式中,错误的是( )
| A. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 过量铁片放入稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 大理石与稀盐酸反应:CaCO3+2H+═CO2↑+H2O+Ca2+ | |
| D. | 氢氧化钙溶液中通入过量CO2:OH-+CO2═HCO3- |
14.下列表述中,正确的是( )
| A. | 常温下,0.1mol•L-1的醋酸钠溶液中,c2(H+)=Kw-c(CH3COOH)•c(H+) | |
| B. | 常温下,各为0.1mol•L-1的NaHCO3和Na2CO3的混合溶液中:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | 向氨水中滴加适量的盐酸呈酸性时,不可能有c(Cl-)>c(H+)=c(NH4+)>c(OH-) | |
| D. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
4.下列叙述正确的是( )
| A. | 氟单质与水反应的化学方程式为F2+H2O═HF+HFO | |
| B. | 碱金属单质在空气中燃烧的生成物都是过氧化物 | |
| C. | x原子的最外层电子数比y原子的少,能说明金属x比金属y的活泼性强 | |
| D. | HCl气体溶于水的过程中,共价键被破坏 |
11.某些金属卤化物可跟其卤素单质反应,如KI+I2?KI3(KI3易溶于水).下列推断错误的是( )
| A. | I3-溶液中存在如下平衡:I3-?I2+I- | |
| B. | 在KI3溶液中加入AgNO3溶液,会析出AgI3沉淀 | |
| C. | 向KI3溶液中通入Cl2,溶液颜色会加深 | |
| D. | 配制碘水时,加入KI可增大I2的溶解度 |
8.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 18g水中所含的电子数为8NA | |
| B. | 常温常压下,28g氮气所含的原子数为2NA | |
| C. | 0.5molCuO的摩尔质量为40g/mol | |
| D. | 22.4L甲烷(CH4)所含的原子数为5NA |
9.1mol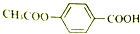 在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
 在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )| A. | 2mol | B. | 3mol | C. | 4mol | D. | 5mol |