题目内容
17.如表对物质的用途及解释都正确的是( )| 选项 | 物质 | 用途 | 解释 |
| A | SO2 | 食品漂白剂 | SO2具有还原性 |
| B | NaClO | 消毒剂 | NaClO具有强氧化性,能杀灭细菌 |
| C | Na2CO3 | 中和过多胃酸 | Na2CO3属于碱 |
| D | 浓硫酸 | 干燥剂 | 浓硫酸具有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫有毒;
B.次氯酸钠具有强的氧化性,能够使蛋白质变性;
C.碳酸钠碱性太强;
D.浓硫酸具有吸水性,能够做干燥剂.
解答 解:A.二氧化硫有毒,不能用来漂白食品,故A错误;
B.次氯酸钠具有强的氧化性,能够使蛋白质变性,所以次氯酸钠能够杀菌消毒,故B正确;
C.碳酸钠碱性太强,能够腐蚀皮肤,不能用来治疗胃酸过多,故C错误;
D.浓硫酸做干燥剂体现其吸水性,故D错误;
故选:B.
点评 本题考查元素化合物性质和用途,明确二氧化硫、次氯酸钠、浓硫酸的性质是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列各反应的离子方程式中,错误的是( )
| A. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 过量铁片放入稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 大理石与稀盐酸反应:CaCO3+2H+═CO2↑+H2O+Ca2+ | |
| D. | 氢氧化钙溶液中通入过量CO2:OH-+CO2═HCO3- |
8.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 18g水中所含的电子数为8NA | |
| B. | 常温常压下,28g氮气所含的原子数为2NA | |
| C. | 0.5molCuO的摩尔质量为40g/mol | |
| D. | 22.4L甲烷(CH4)所含的原子数为5NA |
5.如图所示的实验操作中,正确的是( )
| A. |  检查容量瓶是否漏水 | B. |  给液体加热 | ||
| C. |  滴加液体 | D. |  过滤 |
12.硅及其化合物在生产生活中应用广泛,下列说法错误的是( )
| A. | 水泥是建筑工业的基础材料,可用黏土、石灰石等原料来制得 | |
| B. | 常温下,二氧化硅可与NaOH溶液反应 | |
| C. | 向硅酸钠溶液中滴加稀盐酸,溶液中不会出现沉淀 | |
| D. | 晶体硅是良好的半导体材料 |
2.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3SnCl2+12Cl-+2H3AsO3+6H+═2As+3SnCl62-+6M,关于该反应的说法中不正确的是( )
| A. | M为H2O | |
| B. | SnCl62-是氧化产物 | |
| C. | 还原性:As>SnCl2 | |
| D. | 每生成1molAs,反应中转移电子的物质的量为3mol |
9.1mol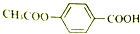 在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
 在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )| A. | 2mol | B. | 3mol | C. | 4mol | D. | 5mol |
6.已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系正确的是( )
| A. | 4 v(NH3)=5 v(O2) | B. | 5v(O2)=6 v(H2O) | C. | 2 v(NH3)=3 v(H2O) | D. | 4v(O2)=5 v(NO) |
7.某化学兴趣小组设计如下方案测定饱和食盐水的电解率.
[提示:饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%]
方案一:连接图甲、乙装置,在洗气瓶a中盛放足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率.

(1)正确的连接顺序为导管口B(填“A”或“B”)连导管口C,若事先往甲装置的饱和食盐水中滴入酚酞,则电解过程甲装置中铁棒(填“铁棒”或“碳棒”)附近的溶液变红.
(2)电解饱和食盐水总反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
方案二:利用甲装置电解后的溶液,通过中和滴定来测定饱和食盐水的电解率.
(3)部分实验过程如下:
①用碱式滴定管(填“酸式滴定管”或“碱式滴定管”)量取10.00mL电解后的溶液,加入锥形瓶中;
②向锥形瓶中加入几滴酚酞试液,用0.2000mol•L-1标准盐酸滴定待测液,边滴边摇动锥形瓶,直到滴入最后一滴时,锥形瓶中溶液颜色由红色变无色,并保持半分钟不褪色时停止滴定;
③该小组所测实验数据如表:
未电解前饱和食盐水的物质的量浓度为5.4mol•L-1,经计算,求出该食盐水的电解率为7.4%.
④下列操作,会导致实验结果偏低的是AB(填序号).
A.滴定时锥形瓶中液滴飞溅出来
B.滴定前读数时平视,终点读数时俯视
C.锥形瓶用蒸馏水洗净后没用待测液润洗
D.酸式滴定管尖端气泡没有排除,滴定后消失.
[提示:饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%]
方案一:连接图甲、乙装置,在洗气瓶a中盛放足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率.

(1)正确的连接顺序为导管口B(填“A”或“B”)连导管口C,若事先往甲装置的饱和食盐水中滴入酚酞,则电解过程甲装置中铁棒(填“铁棒”或“碳棒”)附近的溶液变红.
(2)电解饱和食盐水总反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
方案二:利用甲装置电解后的溶液,通过中和滴定来测定饱和食盐水的电解率.
(3)部分实验过程如下:
①用碱式滴定管(填“酸式滴定管”或“碱式滴定管”)量取10.00mL电解后的溶液,加入锥形瓶中;
②向锥形瓶中加入几滴酚酞试液,用0.2000mol•L-1标准盐酸滴定待测液,边滴边摇动锥形瓶,直到滴入最后一滴时,锥形瓶中溶液颜色由红色变无色,并保持半分钟不褪色时停止滴定;
③该小组所测实验数据如表:
| 实验序号 | 盐酸体积(mL) |
| 第一组 | 19.90 |
| 第二组 | 24.70 |
| 第三组 | 20.10 |
| 第四组 | 20.00 |
④下列操作,会导致实验结果偏低的是AB(填序号).
A.滴定时锥形瓶中液滴飞溅出来
B.滴定前读数时平视,终点读数时俯视
C.锥形瓶用蒸馏水洗净后没用待测液润洗
D.酸式滴定管尖端气泡没有排除,滴定后消失.