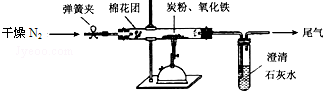
题目内容
15.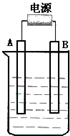 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:(1)A接的是电源的负极,B是该装置阳极,B电极反应式为4OH--4e-=2H2O+O2↑
(2)写出电解时反应的总离子方程式2Cu2++2H2O $\frac{\underline{\;电解\;}}{\;}$ 2Cu+O2↑+4H+.
(3)电解后溶液的pH为1;要使电解后溶液恢复到电解前的状态,则需加入CuO,其质量为2g.(假设电解前后溶液的体积不变)
(4)MnO2可作超级电容器材料.用惰性电极电解酸性MnSO4溶液可制得MnO2,其阳极的 电极反应式是Mn2++2H2O-2e-═MnO2+4H+..
分析 (1)电解质溶液为蓝色溶液,含有Cu2+,用石墨作电极电解观察到A电极表面有红色的固态物质生成,析出的红色固体为Cu,则A为阴极,连接电源的负极,B为阳极,发生氧化反应,B电极有无色气体生成,溶液中水放电生成氢气;
(2)电解时铜离子、水均放电,反应生成Cu、氧气与氢离子;
(3)计算Cu的物质的量,根据电极反应式计算生成氢离子物质的量,计算溶液中氢离子浓度,再根据pH=-lgc(H+)计算溶液pH;析出的物质相当于CuO,加入CuO可以使电解后溶液恢复到电解前的状态,根据Cu元素守恒计算需要加入CuO的质量;
(4)用惰性电极电解酸性MnSO4溶液可制得MnO2,阳极发生氧化反应,Mn2+失去电子转化为MnO2,由氧元素守恒可知有水参与反应,配平书写电极反应式.
解答 解:(1)电解质溶液为蓝色溶液,含有Cu2+,用石墨作电极电解观察到A电极表面有红色的固态物质生成,析出的红色固体为Cu,则A为阴极,连接电源的负极,B为阳极,发生氧化反应,B电极有无色气体生成,溶液中水放电生成氢气,阳极电极反应式为:4OH--4e-=2H2O+O2↑,
故答案为:负;阳;4OH--4e-=2H2O+O2↑;
(2)电解时铜离子、水均放电,反应生成Cu、氧气与氢离子,电解时反应的总离子方程式:2Cu2++2H2O $\frac{\underline{\;电解\;}}{\;}$ 2Cu+O2↑+4H+,
故答案为:2Cu2++2H2O $\frac{\underline{\;电解\;}}{\;}$ 2Cu+O2↑+4H+;
(3)析出Cu的物质的量为$\frac{1.6g}{64g/mol}$=0.025mol,由2Cu2++2H2O $\frac{\underline{\;电解\;}}{\;}$ 2Cu+O2↑+4H+可知,得到氢离子为0.025mol×2=0.05mol,则c(H+)=$\frac{0.05mol}{0.5L}$=0.1mol/L,溶液pH=-lgc(H+)=1,
析出的物质相当于CuO,加入CuO可以使电解后溶液恢复到电解前的状态,由Cu元素守恒可知,加入CuO为0.025mol,需要加入CuO的质量为0.025mol×80g/mol=2g,
故答案为:1;CuO;2g;
(4)用惰性电极电解酸性MnSO4溶液可制得MnO2,阳极发生氧化反应,Mn2+失去电子转化为MnO2,由氧元素守恒可知有水参与反应,阳极电极反应式为:Mn2++2H2O-2e-═MnO2+4H+,
故答案为:Mn2++2H2O-2e-═MnO2+4H+.
点评 本题考查电解原理、电解反应式书写、电解有关计算等,侧重考查学生分析能力与计算能力,关键是明确电解工作原理,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 1s2 | B. | 3s23p4 | C. | 2s22p6 | D. | ns2np3 |
| A. | X、Y、W元素的原子半径依次递增 | |
| B. | X、Z、W元素的最高价氧化物的水化物的酸性依次递增 | |
| C. | X、W分别与Y形成化合物在常温下均为气态 | |
| D. | Z、W分别与Y形成的化合物均可作为耐高温材料 |

| A. | 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 已知图Ⅱ△H<0,由图Ⅱ知,t3时采取的措施是降低反应体系温度 | |
| C. | 由图Ⅱ知,反应在t6时,NH3体积分数最大 | |
| D. | Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出5.16kJ的热量 |
| A. | 汤姆生根据α粒子散射实验提出了“葡萄干面包式”的原子结构模型 | |
| B. | 石油的裂化是为了获得乙烯、丙烯这样的短链烃 | |
| C. | 油脂的主要成分是高级脂肪酸甘油酯 | |
| D. | 淀粉和纤维素互为同分异构体 |
| A. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 过量铁片放入稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 大理石与稀盐酸反应:CaCO3+2H+═CO2↑+H2O+Ca2+ | |
| D. | 氢氧化钙溶液中通入过量CO2:OH-+CO2═HCO3- |
| A. | 氟单质与水反应的化学方程式为F2+H2O═HF+HFO | |
| B. | 碱金属单质在空气中燃烧的生成物都是过氧化物 | |
| C. | x原子的最外层电子数比y原子的少,能说明金属x比金属y的活泼性强 | |
| D. | HCl气体溶于水的过程中,共价键被破坏 |
| A. |  检查容量瓶是否漏水 | B. |  给液体加热 | ||
| C. |  滴加液体 | D. |  过滤 |