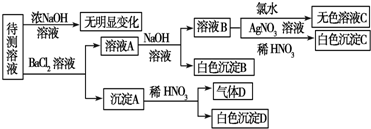
题目内容
16.下列元素-定为主族元素的是( )| A. | 其原子最外电子层有7个电子的元素 | |
| B. | 最高正价为+3的元素 | |
| C. | 其原子最外层电子数大于电子层的元素 | |
| D. | 最高价氧化物对应的水化物是酸的元素 |
分析 A.原子最外电子层有7个电子的元素一定处于ⅦA族;
B.最高正价为+3的元素可能为ⅢA族元素,或处于副族中;
C.其原子最外层电子数大于电子层数的元素,也可能为零族元素;
D.最高价氧化物对应的水化物是酸的元素,可能处于副族,如高锰酸.
解答 解:A.原子最外电子层有7个电子的元素一定处于ⅦA族,故A正确;
B.最高正价为+3的元素可能为ⅢA族元素,也可能为副族中元素,故B错误;
C.其原子最外层电子数大于电子层数的元素,可能是主族元素,也可能为零族元素,如Ne等,故C错误;
D.最高价氧化物对应的水化物是酸的元素,可能为主族元素,也可能处于副族,如高锰酸,故D错误,
故选:A.
点评 本题考查结构性质位置关系应用,注意利用列举反例法进行分析解答,侧重考查元素周期表中规律性与特殊性问题.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
6.下列有关物质的量浓度的相关说法中正确的是( )
| A. | 将25gCuSO4.5H2O晶体加水配成100mL溶液,该溶液的物质的量浓度为1mol/L | |
| B. | 将100mL5mol/L盐酸溶液在蒸发皿中蒸发至50mL溶液,物质的量浓度变为10mol/L | |
| C. | 0.3mol/L的Na2SO4溶液中含有的Na+和SO42- 的总物质的量为0.9mol | |
| D. | 实验室要用容量瓶配制0.2mol/L的NaCl溶液950mL,应称量NaCl固体11.1g |
7.铬及其化合物在工业上有许多用途,但化工废料铬渣对人体健康有很大危害,以制革工也产生的含铬污泥为原料,回收污泥中三价铬的工艺流程图如图所示(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+)
:
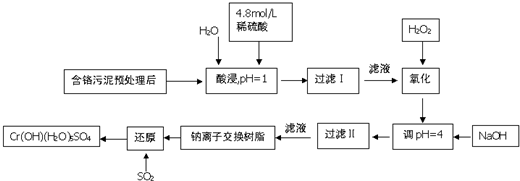
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)能提高浸取时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间
B.升高温度并不断搅拌
C.多次浸取,合并浸取液
D.缩短浸取时间
(2)氧化过程中加入H2O2,除了把Cr3+氧化为Cr2O72-外,另一个作用是2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示).
(3)过滤Ⅱ产生的沉淀是Al(OH)3和Fe(OH)3(填化学式).
(4)钠离子交换树脂的原理为:Mn++nNaR═MRn+nNa+,被交换的杂质离子是Ca2+、Mg2+(填离子符号).
(5)每生成1mol Cr(OH)(H2O)5SO4,消耗SO2物的质量为1.5mol.
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解.经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去.
①铁电极与直流电源正极(填“正极”或“负极”)相连,加入适量NaCl的目的是电解氯化钠溶液得到NaOH,从而将Fe3+、Cr3+与OH-反应生成Fe(OH)3和Cr(OH)3沉淀;
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为3×10-6mol•L-1(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp=[Cr(OH)3]=6.0×10-31)
:

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | 9.3 | 3.7 | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1)能提高浸取时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间
B.升高温度并不断搅拌
C.多次浸取,合并浸取液
D.缩短浸取时间
(2)氧化过程中加入H2O2,除了把Cr3+氧化为Cr2O72-外,另一个作用是2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示).
(3)过滤Ⅱ产生的沉淀是Al(OH)3和Fe(OH)3(填化学式).
(4)钠离子交换树脂的原理为:Mn++nNaR═MRn+nNa+,被交换的杂质离子是Ca2+、Mg2+(填离子符号).
(5)每生成1mol Cr(OH)(H2O)5SO4,消耗SO2物的质量为1.5mol.
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解.经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去.
①铁电极与直流电源正极(填“正极”或“负极”)相连,加入适量NaCl的目的是电解氯化钠溶液得到NaOH,从而将Fe3+、Cr3+与OH-反应生成Fe(OH)3和Cr(OH)3沉淀;
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为3×10-6mol•L-1(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp=[Cr(OH)3]=6.0×10-31)
4.由下列微粒的最外层电子排布,能确定形成该微粒的元素在周期表中的位置是( )
| A. | 1s2 | B. | 3s23p4 | C. | 2s22p6 | D. | ns2np3 |
11.下列操作所得结论正确的是( )
| 选项 | 实验操作 | 结论 |
| A | 用容量瓶配制溶液时,若定容摇匀后液面低于刻度线,补加水至与刻度线相平 | 所配溶液浓度不受影响 |
| B | 用湿润的pH试纸测定氯水的pH | 所得溶液的pH偏大 |
| C | 不断通入HCl的条件下,将TiCl4溶液蒸发浓缩、降温结晶 | 可以得到更纯净的TiCl4固体 |
| D | 用托盘天平称取一定质量的NaCl固体,左盘放砝码,右盘放固体 | 所称NaCl质量一定偏小 |
| A. | A | B. | B | C. | C | D. | D |
9.下列有关金属的说法中,正确的是( )
①在人类对金属材料的使用过程中,性质活泼的金属单质最早被人们冶炼和使用
②生铁的熔点比纯铁低,硬度比纯铁大
③单质铝在空气中比较耐腐蚀,所以铝是不活泼金属
④正常人体缺钙会引起骨质疏松症,缺铁会引起贫血等疾病
⑤青铜、不锈钢、硬铝都是合金
⑥可通过焰色反应区分钾元素和钠元素.
①在人类对金属材料的使用过程中,性质活泼的金属单质最早被人们冶炼和使用
②生铁的熔点比纯铁低,硬度比纯铁大
③单质铝在空气中比较耐腐蚀,所以铝是不活泼金属
④正常人体缺钙会引起骨质疏松症,缺铁会引起贫血等疾病
⑤青铜、不锈钢、硬铝都是合金
⑥可通过焰色反应区分钾元素和钠元素.
| A. | ②④⑤⑥ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②⑤⑥ |
6.短周期元素X、Y、Z、W的原子序数依次增大,W与X同主族,Y的最外层电子数是电子层数的3倍,Y与W核外电子数相差6,Z的最外层电子数等于电子层数.下列说法正确的是( )
| A. | X、Y、W元素的原子半径依次递增 | |
| B. | X、Z、W元素的最高价氧化物的水化物的酸性依次递增 | |
| C. | X、W分别与Y形成化合物在常温下均为气态 | |
| D. | Z、W分别与Y形成的化合物均可作为耐高温材料 |
7.下列各反应的离子方程式中,错误的是( )
| A. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 过量铁片放入稀硝酸中:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 大理石与稀盐酸反应:CaCO3+2H+═CO2↑+H2O+Ca2+ | |
| D. | 氢氧化钙溶液中通入过量CO2:OH-+CO2═HCO3- |