题目内容
5.某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2,A12O3等.已知FeCO3、Mn-CO3难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锸矿中提取金属锰,主要物质转化关系如下: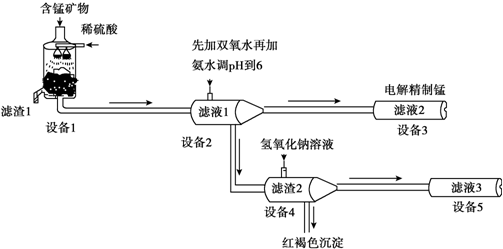
(1)设备Ⅰ中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2. 滤渣1的主要成分是SiO2(填化学式).
(2)设备1中发生氧化还原反应的离子方程式是2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O 或2FeCO3+MnO2+8H+=2Fe3++Mn2++CO2↑+4H2O.
(3)设备2中加足量双氧水的作用是将Fe2+完全氧化为Fe3+.设计实验方案检验滤液2中是否存在Fe2+:取滤液2,加入铁氰化钾溶液,如果有蓝色沉淀产生,则有Fe2+,否则没有Fe2+.
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,用化学平衡移动原理解释原因:滤渣2中存在Al(OH)3,存在电离平衡:Al3++3OH-?Al(OH)3?AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.
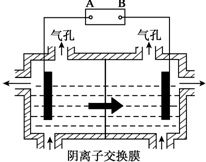 (5)设备3中用阴离子膜法提取金属锰的电解装置如图:
(5)设备3中用阴离子膜法提取金属锰的电解装置如图:①电解装置中箭头表示溶液中阴离子移动的方向;则A电极是直流电源的负极.实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为4OH--4e-═2H2O+O2↑或者2H2O-4e-=O2↑+4H+.
②该工艺之所以采用阴离子交换膜,是为了防止Mn2+ 进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式Mn2++2H2O-2e-=MnO2+4H+.
分析 锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等,用硫酸溶解,SiO2不硫酸反应,MnCO3、FeCO3、Al2O3与硫酸反应得到MnSO4、FeSO4、Al2(SO4)3,而滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2,酸性条件下MnO2将Fe2+离子氧化为Fe3+离子,过滤除去二氧化硅等不溶物,滤渣1为SiO2等不溶物.滤液1中加入过氧化氢将Fe2+离子氧化为Fe3+离子,再加入氨水调节溶液pH使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤液2中含有MnSO4、NH4SO4等,滤渣2为Fe(OH)3、Al(OH)3,向滤渣2中加入氢氧化钠,氢氧化铝溶解得到NaAlO2,过滤分离.滤液2电解得到Mn.
(1)滤渣1的主要成分是二氧化硅;
(2)设备1中发生氧化还原反应:二氧化锰在酸性条件下将+2价铁氧化为铁离子,二氧化硫被还原得到Mn2+;
(3)设备2中加足量双氧水将Fe2+离子氧化为Fe3+离子;利用加入铁氰化钾溶液检验Fe2+离子;
(4)Al(OH)3存在电离平衡:Al3++3OH-?Al(OH)3?AlO2-+H++H2O,加入NaOH溶液,H+被中和,平衡正向移动,氢氧化铝被溶解;
(5)①电解装置中箭头表示溶液中阴离子移动的方向,则左室为阴极室,右室为阳极室,A为电源的负极,B为电源的阳极,阳极以稀硫酸为电解液,溶液中氢氧根离子放电生成氧气;
②Mn2+进入阳极区,发生氧化反应生成MnO2,需要有水参与反应,根据电荷守恒可知有氢离子生成.
解答 解:锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等,用硫酸溶解,SiO2不硫酸反应,MnCO3、FeCO3、Al2O3与硫酸反应得到MnSO4、FeSO4、Al2(SO4)3,而滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2,酸性条件下MnO2将Fe2+离子氧化为Fe3+离子,过滤除去二氧化硅等不溶物,滤渣1为SiO2等不溶物.滤液1中加入过氧化氢将Fe2+离子氧化为Fe3+离子,再加入氨水调节溶液pH使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤液2中含有MnSO4、NH4SO4等,滤渣2为Fe(OH)3、Al(OH)3,向滤渣2中加入氢氧化钠,氢氧化铝溶解得到NaAlO2,过滤分离.滤液2电解得到Mn.
(1)滤渣1的主要成分是SiO2,故答案为:SiO2;
(2)设备1中发生氧化还原反应:二氧化锰在酸性条件下将+2价铁氧化为铁离子,二氧化硫被还原得到Mn2+,反应离子方程式为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O 或2FeCO3+MnO2+8H+=2Fe3++Mn2++CO2↑+4H2O,
故答案为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O 或2FeCO3+MnO2+8H+=2Fe3++Mn2++CO2↑+4H2O;
(3)设备2中加足量双氧水将Fe2+离子氧化为Fe3+离子,便于调节pH时转化为沉淀除去,检验滤液2中是否存在Fe2+的方案为:取滤液2,加入铁氰化钾溶液,如果有蓝色沉淀产生,则有Fe2+,否则没有Fe2+,
故答案为:将Fe2+完全氧化为Fe3+;取滤液2,加入铁氰化钾溶液,如果有蓝色沉淀产生,则有Fe2+,否则没有Fe2+;
(4)滤渣2中存在Al(OH)3,存在电离平衡:Al3++3OH-?Al(OH)3?AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解,
故答案为:滤渣2中存在Al(OH)3,存在电离平衡:Al3++3OH-?Al(OH)3?AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解;
(5)①电解装置中箭头表示溶液中阴离子移动的方向,则左室为阴极室,右室为阳极室,A为电源的负极,B为电源的阳极,阳极以稀硫酸为电解液,溶液中氢氧根离子放电生成氧气,电极反应为:4OH--4e-═2H2O+O2↑或者2H2O-4e-=O2↑+4H+,
故答案为:负;4OH--4e-═2H2O+O2↑或者2H2O-4e-=O2↑+4H+;
②Mn2+进入阳极区,发生氧化反应生成MnO2,需要有水参与反应,根据电荷守恒可知有氢离子生成,该副反应的电极反应式:Mn2++2H2O-2e-=MnO2+4H+,
故答案为:Mn2++2H2O-2e-=MnO2+4H+.
点评 本题考查学生对工艺流程的理解、阅读题目获取信息能力、物质的分离提纯、化学平衡移动、电解原理等,综合性较大,题目难度中等,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |
| A. | 第I A族元素的化合物 | B. | 第III A族元素的化合物 | ||
| C. | 第IV A族元素的化合物 | D. | 第VII A族元素的化合物 |
| A. | 分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| A. | FeS2$\stackrel{煅烧}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | NaCl(aq)$\stackrel{电解}{→}$Na$\stackrel{O_{2}}{→}$Na2O2 | |
| C. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq)$\stackrel{NaOH(aq)}{→}$Fe(OH)2$\stackrel{空气中灼烧}{→}$Fe2O3 | |
| D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$Fe |
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: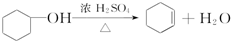
可能用到的有关数据如下:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是圆底烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B.
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶
D.球形冷凝管 E.接收器
(6)本实验所得到的环己烯产率是61%.
| A. | Ba2+ | B. | Fe3+ | C. | Ag+ | D. | Mg2+ |
| A. | 1L水中溶解了58.5g NaCl,该溶液的物质的量浓度为1mol/L | |
| B. | V L Fe2(SO4)3溶液中含a g SO42-,取此溶液0.5VL用水稀释成2V L,则稀释后溶液的c(Fe3+)为$\frac{a}{4V}$ mol/L | |
| C. | 实验室需240mL2mol/L的CuSO4溶液,配置时应称125.0gCuSO4•5H2O | |
| D. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,质量分数变为9.8% |
| A. | 苯酚和甲醛在一定条件下可合成酚醛树脂 | |
| B. | 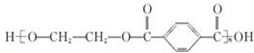 的单体是 HOCH2CH2OH 与 的单体是 HOCH2CH2OH 与  | |
| C. | 聚苯乙烯是由苯乙烯加聚生成的纯净物 | |
| D. | 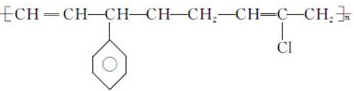 的单体有3种 的单体有3种 |