题目内容
14.下列说法正确的是( )| A. | 1L水中溶解了58.5g NaCl,该溶液的物质的量浓度为1mol/L | |
| B. | V L Fe2(SO4)3溶液中含a g SO42-,取此溶液0.5VL用水稀释成2V L,则稀释后溶液的c(Fe3+)为$\frac{a}{4V}$ mol/L | |
| C. | 实验室需240mL2mol/L的CuSO4溶液,配置时应称125.0gCuSO4•5H2O | |
| D. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,质量分数变为9.8% |
分析 A、溶液的体积不等于溶剂的体积;
B、根据n=$\frac{m}{M}$计算出ag硫酸根离子的物质的量,再计算出0.5VL溶液中硫酸根离子的物质的量,然后根据硫酸铁的化学式计算出铁离子的物质的量,最后根据c=$\frac{n}{V}$计算出稀释后溶液中Fe3+的物质的量浓度;
C、实验室需240mL2mol/L的CuSO4溶液,应选用250mL的容量瓶,所以配置时应称250×10-3×2×250=125.0gCuSO4•5H2O;
D、根据浓硫酸与稀硫酸的密度不同,稀释后硫酸的质量分数大于9.8%.
解答 解:A、1 L水中溶解了58.5 g NaCl,溶液的体积不等于1L,无法求出溶液的物质的量浓度,故A错误;
B、ag硫酸根离子的物质的量为:$\frac{ag}{96g/mol}$=$\frac{a}{96}$mol,取出的0.5VL溶液中含有硫酸根离子的物质的量为:$\frac{a}{96}$mol×$\frac{0.5VL}{VL}$=$\frac{a}{192}$mol,稀释过程中溶质的物质的量不变,则稀释后溶液中铁离子物质的量为:$\frac{a}{192}$mol×$\frac{2}{3}$=$\frac{a}{288}$mol,稀释后溶液中铁离子浓度为:$\frac{\frac{a}{288}mol}{2VL}$=$\frac{a}{576V}$mol/L,故B错误;
C、实验室需240mL2mol/L的CuSO4溶液,应选用250mL的容量瓶,所以配置时应称250×10-3×2×250=125.0gCuSO4•5H2O,故C正确;
D、10mL质量分数为98%的H2SO4,用水稀释至100mL,由于硫酸溶液的密度大于水的密度,所以稀释后H2SO4的质量分数大于9.8%,故D错误;
故选C.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确稀释过程中溶质的物质的量不变为解答关键,注意掌握物质的量与摩尔质量、物质的量浓度之间的关系,试题培养了学生的化学计算能力.

| A. | 加入固体硫酸钠 | B. | 滴加几滴硫酸铜溶液 | ||
| C. | 升高稀硫酸温度 | D. | 加入硫酸钠溶液 |
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-) | |
| B. | 20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:C(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+ )>c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
| A. | 葡萄糖浓度太大 | B. | 加热时间不够 | ||
| C. | CuSO4溶液的量不够 | D. | NaOH溶液的量不够 |
 工业尾气SO2有多种吸收和处理方法.
工业尾气SO2有多种吸收和处理方法.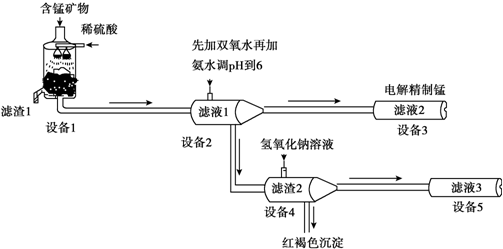
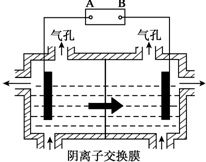 (5)设备3中用阴离子膜法提取金属锰的电解装置如图:
(5)设备3中用阴离子膜法提取金属锰的电解装置如图: