题目内容
10. 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: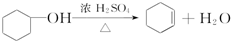
可能用到的有关数据如下:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是圆底烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B.
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶
D.球形冷凝管 E.接收器
(6)本实验所得到的环己烯产率是61%.
分析 (1)根据仪器的特征以及常见仪器的名称解答;
(2)碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入;
(3)有活塞开关的玻璃仪器,使用前需要检查是否漏液;分液过程中,密度小的液体在上层,需从分液漏斗的上口倒出;
(4)无水氯化钙用于吸收产物中少量的水;
(5)观察题目提供的实验装置图知蒸馏过程中不可能用到吸滤瓶和球形冷凝器管;
(6)20g环己醇物质的量为0.2mol,理论上可以得到0.2mol环己烯,其质量为16.4g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)依据装置图分析可知装置a是蒸馏装置中的圆底烧瓶仪器,盛放20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,
故答案为:圆底烧瓶;
(2)碎瓷片具有疏松多孔,能引入汽化中心,碎瓷片的存在可以防止在加热过程中产生暴沸现象,补加碎瓷片时需要待已加热的试液冷却后再加入,
故答案为:防止暴沸;B;
(3)由于分液漏斗有活塞开关,故使用前需要检查是否漏液;分液过程中,由于环己烯的密度比水的密度小,故应该从分液漏斗的上口倒出,
故答案为:检漏;上口倒出;
(4)分离提纯过程中加入无水氯化钙的目的是利用无水氯化钙吸收产物中少量的水,
故答案为:干燥;
(5)球形冷凝管可以存留部分冷凝水,不能用于组装成蒸馏装置,抽滤操作安全瓶中连接吸滤瓶,所以观察题目提供的实验装置图知蒸馏过程中不可能用到吸滤瓶和球形冷凝器管,
故答案为:CD;
(6)20g环己醇的物质的量为n=$\frac{m}{M}$=$\frac{20g}{100g/mol}$=0.2mol,理论上可以得到0.2mol环己烯,其质量为16.4g,所以产率=$\frac{实际产量}{理论产量}$×100%=$\frac{10g}{16.4g}$×100%=61%,
故答案为:61%.
点评 本题考查了物质制备实验方案设计,醇性质的分析应用,实验现象和原理的分析判断,掌握实验基本操作以及醇的性质是解题关键,题目难度中等.

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案| A. | 7.69mol/L 14.5% | B. | 8.15mol/L 15.4% | C. | 7.69mol/L 15.4% | D. | 8.17mol/L 14.5% |
| A. | 0.1mol•L -1AgNO3,溶液:H+、K+、SO42-、I- | |
| B. | c( H+ )/c( OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 由水电离的 c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | 甲基橙呈红色的溶液中:Na+、CO32-、Fe3+、Cl- |
| A. | 1mol/LBaCl2溶液中含有的Ba2+数为NA | |
| B. | 1mol镁离子中含有的电子数为2NA | |
| C. | 常温常压下,11.2LH2中含有H2数为0.5NA | |
| D. | 16gO3中含有氧原子数为NA |
| A. | 加入固体硫酸钠 | B. | 滴加几滴硫酸铜溶液 | ||
| C. | 升高稀硫酸温度 | D. | 加入硫酸钠溶液 |
| A. | 6.72、1.56、6.72 | B. | 4.62、5.6、3.78 | C. | 6、8、7 | D. | 6.72、6.72、1.56 |
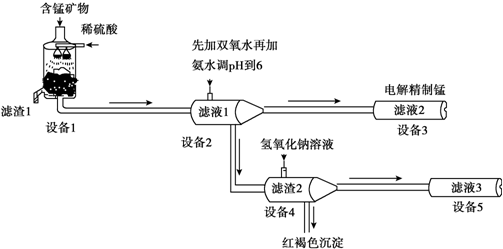
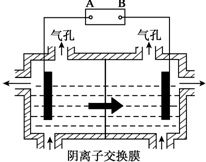 (5)设备3中用阴离子膜法提取金属锰的电解装置如图:
(5)设备3中用阴离子膜法提取金属锰的电解装置如图: