题目内容
13.下列实验操作中正确的是( )| A. | 分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
分析 A.分液时应避免液体重新混合而污染;
B.蒸发时应避免温度过高而导致固体迸溅;
C.容量瓶只能在常温下使用;
D.萃取剂的选择与密度的大小无关.
解答 解:A.分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出,这样的操作会使上层的液体经过分液漏斗下端时,沾上分液漏斗的内壁上沾有的下层的液体,应从上口倒出,避免液体重新混合而污染,故A错误;
B.蒸发结晶时,当蒸发皿中有大量固体出现时,就应停止加热,移去酒精灯,用余热将溶液蒸干,避免温度过高而导致固体迸溅,故B错误;
C.容量瓶用于配制一定浓度的溶液,为定量仪器,只能在常温下使用,故C正确;
D.萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶,密度可以比水大,也可以比水小;萃取剂与溶质不反应,故D错误.
故选C.
点评 本题考查较为综合,涉及实验的基本操作以及实验仪器使用时的注意事项等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.按要求回答下列问题
(1)写出下列物质在水中的电离方程式
①NaHCO3NaHCO3═Na++HCO3-;②HClOHClO?H++ClO-.
(2)若要除去下列溶液中的杂质(括号内为杂质),请将选用的试剂及有关反应的离子方程式填入下表的空白处:
(3)镁着火不能用二氧化碳来灭火,理由是2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C(用化学方程式表示)
(4)写出离子方程式CO32-+2H+═CO2↑+H2O所对应的化学方程式Na2CO3+2HCl=2NaCl+CO2+H2O.
(1)写出下列物质在水中的电离方程式
①NaHCO3NaHCO3═Na++HCO3-;②HClOHClO?H++ClO-.
(2)若要除去下列溶液中的杂质(括号内为杂质),请将选用的试剂及有关反应的离子方程式填入下表的空白处:
| 物质(杂质) | 试剂 | 有关离子方程式 |
| NaHCO3(Na2CO3) | ||
| FeCl2(FeCl3) |
(4)写出离子方程式CO32-+2H+═CO2↑+H2O所对应的化学方程式Na2CO3+2HCl=2NaCl+CO2+H2O.
1.在标准状况下,1体积水溶解224体积氨气,所得溶液密度为0.9g/cm3,这种氨水的物质的量浓度和质量分数分别为( )
| A. | 7.69mol/L 14.5% | B. | 8.15mol/L 15.4% | C. | 7.69mol/L 15.4% | D. | 8.17mol/L 14.5% |
18.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol•L -1AgNO3,溶液:H+、K+、SO42-、I- | |
| B. | c( H+ )/c( OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 由水电离的 c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | 甲基橙呈红色的溶液中:Na+、CO32-、Fe3+、Cl- |
2.要降低过量Zn和一定量稀H2SO4间反应生成氢气速率,下列措施正确的是( )
| A. | 加入固体硫酸钠 | B. | 滴加几滴硫酸铜溶液 | ||
| C. | 升高稀硫酸温度 | D. | 加入硫酸钠溶液 |
9.某学生做葡萄糖的还原性实验,4mL 0.5mol/L的CuSO4溶液和4mL 0.5mol/L的NaOH溶液,将它们混合后,滴入1.0mL的10%的葡萄糖溶液,加热煮沸,结果没有看到红色沉淀生成.这是因为( )
| A. | 葡萄糖浓度太大 | B. | 加热时间不够 | ||
| C. | CuSO4溶液的量不够 | D. | NaOH溶液的量不够 |
 工业尾气SO2有多种吸收和处理方法.
工业尾气SO2有多种吸收和处理方法.
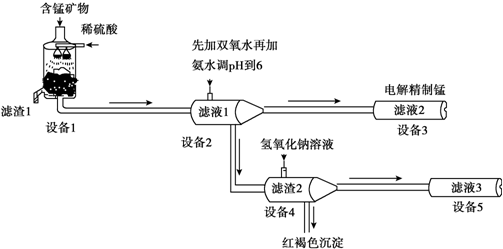
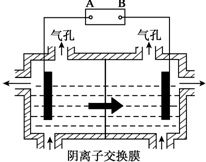 (5)设备3中用阴离子膜法提取金属锰的电解装置如图:
(5)设备3中用阴离子膜法提取金属锰的电解装置如图: