题目内容
20.下列物质转化在给定条件下能实现的是( )| A. | FeS2$\stackrel{煅烧}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | NaCl(aq)$\stackrel{电解}{→}$Na$\stackrel{O_{2}}{→}$Na2O2 | |
| C. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq)$\stackrel{NaOH(aq)}{→}$Fe(OH)2$\stackrel{空气中灼烧}{→}$Fe2O3 | |
| D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$Fe |
分析 A.FeS2和氧气反应生成二氧化硫;
B.电解氯化钠溶液生成氢氧化钠;
C.铁和稀硫酸反应生成硫酸亚铁,硫酸亚铁与氢氧化钠反应生成氢氧化亚铁,在空气中灼烧可生成氧化铁;
D.氯化铁和铜反应生成氯化铜、氯化亚铁.
解答 解:A.FeS2和氧气反应生成二氧化硫,不能直接生成三氧化硫,二氧化硫和氧气在催化作用下可生成三氧化硫,故A错误;
B.电解氯化钠溶液生成氢氧化钠,工业可用电解氯化钠可生成钠,故B错误;
C.铁和稀硫酸反应生成硫酸亚铁,硫酸亚铁与氢氧化钠反应生成氢氧化亚铁,在空气中灼烧时氢氧化亚铁生成氢氧化铁,分解可生成氧化铁,故C正确;
D.氯化铁和铜反应生成氯化铜、氯化亚铁,不能置换出铁,故D错误.
故选C.
点评 本题考查物质之间的转化,为高频考点,明确元素化合物性质及其转化关系是解本题关键,注意物质性质特殊性质,知道金属的冶炼方法与金属活泼性的关系,题目难度不大.

练习册系列答案
相关题目
10.蛇纹石矿可以看做是由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁的实验步骤如下:
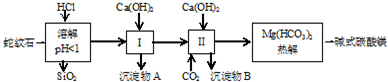
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是Fe3+、Al3+.
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见表)
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3溶解、Mg(OH)2沉淀生成.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入过量NaOH(填入物质的化学式),然后过滤、洗涤、灼烧 (依次填写实验操作名称).
(4)Mg(HCO3)2热分解的反应方程式为:2 Mg(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$Mg2(OH)2CO3+3CO2↑+H2O.若热分解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数降低(填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量为142).
(5)上述实验中,可以循环使用的物质是CO2(填写物质化学式).
(6)除去MgCl2酸性溶液中的Fe3+,可在加热、搅拌的条件下加入MgO或Mg(OH)2或MgCO3(试剂自选),过滤后再加入适量盐酸.

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见表)
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致Al(OH)3溶解、Mg(OH)2沉淀生成.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入过量NaOH(填入物质的化学式),然后过滤、洗涤、灼烧 (依次填写实验操作名称).
(4)Mg(HCO3)2热分解的反应方程式为:2 Mg(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$Mg2(OH)2CO3+3CO2↑+H2O.若热分解不完全,所得碱式碳酸镁中将混有MgCO3,则产品中镁的质量分数降低(填“升高”、“降低”或“不变”,已知碳酸镁的相对分子质量为84,碱式碳酸镁的相对分子质量为142).
(5)上述实验中,可以循环使用的物质是CO2(填写物质化学式).
(6)除去MgCl2酸性溶液中的Fe3+,可在加热、搅拌的条件下加入MgO或Mg(OH)2或MgCO3(试剂自选),过滤后再加入适量盐酸.
11.下列高聚物经简单处理可以从线型结构变成体型结构的是( )
①
②
③
④
①

②

③

④

| A. | ①② | B. | ③④ | C. | ①④ | D. | ②③ |
16.下列叙述中,正确的是( )
| A. | B的阳离子的氧化性比A的阳离子强,说明A元素的金属性一定比B元素强 | |
| B. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 | |
| C. | 一种元素可能有多种氧化物,但同一化合价只对应一种氧化物 | |
| D. | 强氧化剂与强还原剂不一定能发生氧化还原反应 |


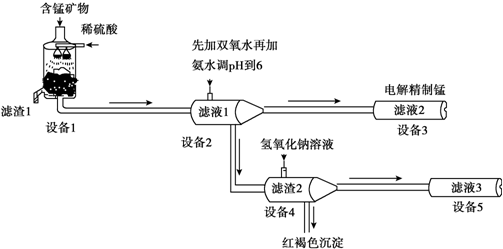
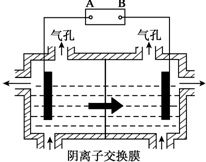 (5)设备3中用阴离子膜法提取金属锰的电解装置如图:
(5)设备3中用阴离子膜法提取金属锰的电解装置如图: