题目内容
18.某金属粉末样品除含镁外,还可能含有铝和锌的一种或两种,实验小组设计如下流程进行检验.
已知:①供选试剂和用品:样品、稀硫酸、NaOH溶液、稀氨水
②单质Zn的性质与单质Al相似
③Zn(OH)2为白色难溶于水固体,可溶于强碱及NH3•H2O
④Zn2+易形成[Zn(NH3)4]2+,该离子遇强酸生成Zn2+、NH4+
请回答:
(1)试剂A、试剂B、试剂C分别为NaOH溶液、稀硫酸、稀氨水.
(2)沉淀A、沉淀C、沉淀D的化学式分别为Mg、Al(OH)3、Zn(OH)2.
分析 由题给信息可知铝和锌性质相似,则都可碱溶液反应,试剂A为NaOH溶液,沉淀A为Mg,滤液B为NaAlO2和Na2ZnO2,试剂B为稀硫酸,可生成Zn(OH)2、Al(OH)3沉淀,即沉淀B,因Zn(OH)2溶于氨水而氢氧化铝不溶,则试剂C为氨水,沉淀C为Al(OH)3,滤液B含有[Zn(NH3)4]2+,分别加入稀硫酸生成Zn2+、NH4+
,在加入适量NaOH溶液可生成Zn(OH)2,即沉淀D,滤液C含有硫酸铵,以此解答该题.
解答 解:由题给信息可知铝和锌性质相似,则都可碱溶液反应,试剂A为NaOH溶液,沉淀A为Mg,滤液B为NaAlO2和Na2ZnO2,试剂B为稀硫酸,可生成Zn(OH)2、Al(OH)3沉淀,即沉淀B,因Zn(OH)2溶于氨水而氢氧化铝不溶,则试剂C为氨水,沉淀C为Al(OH)3,滤液B含有[Zn(NH3)4]2+,分别加入稀硫酸生成Zn2+、NH4+
,在加入适量NaOH溶液可生成Zn(OH)2,即沉淀D,滤液C含有硫酸铵,
(1)由以上分析可知试剂A为NaOH溶液,B为稀硫酸,C为稀氨水,故答案为:NaOH溶液;稀硫酸;稀氨水;
(2)由以上分析可知沉淀A为Mg,C为Al(OH)3,D为Zn(OH)2,故答案为:Mg;Al(OH)3;Zn(OH)2.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及题给信息,为解答该题的关键,难度中等.

练习册系列答案
相关题目
9.一定温度下,可逆反应3X(g)+Y(g)?2Z(g)达到化学平衡状态的标志是( )
| A. | 单位时间内生成3n mol X,同时消耗n mol Y | |
| B. | X的生成速率与Z的消耗速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | X、Y、Z的物质的量之比为3:1:2 |
6.下列有关表述中正确的是( )
| A. | 氧化铁的化学式:FeO | |
| B. | 聚乙烯的结构简式为CH2=CH2 | |
| C. | 16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体 | |
| D. | 质子数为53,中子数为78的碘原子表示为:${\;}_{53}^{131}$I |
10.X、Y、Z三者均为短周期元素,已知X元素有一种同位素不含中子,Y元素原子的最外层电子数是次外层电子数的2倍,Z元素原子的最外层电子数是次外层电子数的3倍.下列化学式①XYZ3②X2YZ2③X2YZ3④X2Y2Z2⑤X2Y2Z4⑥X4Y2Z2中,并非都存在的一组分子是( )
| A. | ①② | B. | ④⑥ | C. | ③⑤ | D. | ②④ |
17. 取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)
取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)
请回答下列问题:
(1)实验1、2研究的是温度对H2O2分解速率的影响.
(2)实验2、3的目的是不同催化剂对过氧化氢分解速率的影响.
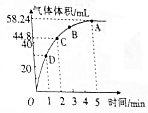
(3)加入0.1mol MnO2粉末于50mL过氧化氢溶液(密度为1.1g•mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
①A、B、C、D四点的化学反应速率快慢的顺序为D>C>B>A.
②过氧化氢的初始物质的量浓度为0.104 mol•L-1.
③反应进行到2min时过氧化氢的质量分数为0.074%.
 取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)
取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略) | 序号 | 条件 | 现象和结论 | |
| 温度/℃ | 催化剂 | ||
| 1 | 40 | FeCl3溶液 | |
| 2 | 20 | FeCl3溶液 | |
| 3 | 20 | MnO2 | |
(1)实验1、2研究的是温度对H2O2分解速率的影响.
(2)实验2、3的目的是不同催化剂对过氧化氢分解速率的影响.
(3)加入0.1mol MnO2粉末于50mL过氧化氢溶液(密度为1.1g•mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
①A、B、C、D四点的化学反应速率快慢的顺序为D>C>B>A.
②过氧化氢的初始物质的量浓度为0.104 mol•L-1.
③反应进行到2min时过氧化氢的质量分数为0.074%.
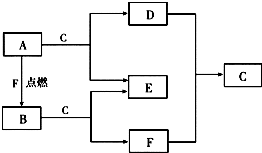 A、D、F均是由短周期元素组成的单质,常温下C是液体.
A、D、F均是由短周期元素组成的单质,常温下C是液体.
 ④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.
④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.