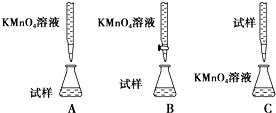
题目内容
3.现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀.请回答问题:
(1)写出下列物质的化学式:ANa;JFe(OH)3.
(2)转化I+G→J+C的反应类型为复分解反应.
分析 已知通常情况下A为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀,推断J为Fe(OH)3,F为H2O,E为Na2O2,G为NaOH,D为O2,判断A为Na,B为Cl2,C为NaCl,I为FeCl3,H为FeCl2,据此分析回答问题.
解答 解:由上述转化关系分析可知,已知通常情况下A为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀,推断J为Fe(OH)3,F为H2O,E为Na2O2,G为NaOH,D为O2,判断A为Na,B为Cl2,C为NaCl,I为FeCl3,H为FeCl2,
(1)A为Na,J为Fe(OH)3,故答案为:Na;Fe(OH)3;
(2)转化I+G→J+C的反应为氯化铁和氢氧化钠溶液反应,FeCl3+3NaOH=Fe(OH)3 +3NaCl,反应为复分解反应,故答案为:复分解反应;
点评 本题考查了无机物质的转化关系、物质性质的理解应用、主要是反应现象和反应产物的推断,需要学生熟练掌握基础,题目难度中等.

练习册系列答案
相关题目
13.以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性.
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3.用离子方程式解释现象Ⅰ:2Ag++SO32-=Ag2SO3↓.
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-.
已知:Cu+$\stackrel{稀硫酸}{→}$Cu+Cu2+,Cu2+$\stackrel{I-}{→}$CuI↓(白色)+I2.
①用稀硫酸证实沉淀中含有Cu+的实验现象是析出红色固体.
②通过下列实验证实,沉淀中含有Cu2+和SO32-.

a.白色沉淀A是BaSO4,试剂1是HCl和BaCl2溶液.
b.证实沉淀中含有Cu+和SO32-的理由是棕黄色沉淀与KI溶液反应生成白色沉淀(CuI),证明含有Cu2+,白色沉淀A为硫酸钡,证明含有SO32-.
| 实验 | 试剂 | 现象 | |
| 滴管 | 试管 | ||
 | 0.2mol/L Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ产生白色沉淀 |
| 0.2mol/LCuSO4溶液 | Ⅱ溶液变绿,继续滴加产生棕黄色沉淀 | ||
| 0.1mol/LAl2(SO4)3溶液 | Ⅲ开始无明显变化,继续滴加产生白色沉淀 | ||
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-.
已知:Cu+$\stackrel{稀硫酸}{→}$Cu+Cu2+,Cu2+$\stackrel{I-}{→}$CuI↓(白色)+I2.
①用稀硫酸证实沉淀中含有Cu+的实验现象是析出红色固体.
②通过下列实验证实,沉淀中含有Cu2+和SO32-.

a.白色沉淀A是BaSO4,试剂1是HCl和BaCl2溶液.
b.证实沉淀中含有Cu+和SO32-的理由是棕黄色沉淀与KI溶液反应生成白色沉淀(CuI),证明含有Cu2+,白色沉淀A为硫酸钡,证明含有SO32-.
14.下列电离方程式正确的是( )
| A. | CuSO4═Cu+2+SO4-2 | B. | NH4NO3═NH4++NO3- | ||
| C. | Na2CO3═Na2++CO32- | D. | KClO3═K++Cl-+3O2- |
11.下列各组离子,在指定的环境中一定能大量共存的是( )
| A. | 在由水电离出的c(OH-)=10-13mol/L的溶液中:Na+、Ba2+、Cl-、I- | |
| B. | 在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| C. | 在能使pH试纸变深蓝色的溶液中:Na+、S2-、NO3-、CO32- | |
| D. | 在pH为7的溶液中:Ag+、K+、SO42-、Cl- |
1.某化学反应2A?B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为0.013mol/(L•min).
(2)在实验2,A的初始浓度c2=1.0mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是催化剂.
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3>v1(填>、=、<),且c3=>1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是反应吸热(选填吸热、放热).理由是由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动.
| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 050 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.60 |
(1)在实验1,反应在10至20分钟时间内平均速率为0.013mol/(L•min).
(2)在实验2,A的初始浓度c2=1.0mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是催化剂.
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3>v1(填>、=、<),且c3=>1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是反应吸热(选填吸热、放热).理由是由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动.
2.将3.52g CO2和SO2混合气体通入一定量的NaOH溶液中,气体全部与NaOH反应生成盐,将反应后的溶液减压低温蒸干后得到不含结晶水的固体,固体的质量可能为( )
| A. | 8.48 g | B. | 7.48 g | C. | 5.72 g | D. | 5.22g |