题目内容
16.(I)甲烷在一定条件下可生成以下微粒:A.碳正离子(CH3+ ) B.碳负离子(CH3-) C.甲基 (-CH3) D.碳烯(:CH2)
①四种微粒中,键角为120°的是A(填序号).
②碳负离子(CH3-)的空间构型为三角锥形,与CH3-互为等电子体的一种分子是NH3(填化学式).
(II )在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学方程式为(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①C、N、O的电负性由大到小的顺序为O>N>C.
②写出Cu的核外电子排布式1s22s22p63s23p63d104s1或[Ar]3d104s1.
③化合物Cu(NH3)3(CO)Ac中,金属元素的化合价为+1.
 ④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.
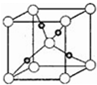
④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.⑤Cu2O晶体的晶胞结构如图所示,若阿伏伽德罗常数为NA,晶胞的边长为apm,则晶体的密度为$\frac{288×1{0}^{30}}{{N}_{A}•{a}^{3}}$g•cm-3.
分析 (I) ①根据价层电子对互斥理论确定中心原子杂化方式和微粒空间构型来判断;
②碳负离子(CH3-)含有3个σ键,1对孤电子对,从而确定分子构型;原子个数相等、价电子数相同的微粒互为等电子体;
(II )①同周期从左到右电负性越来越大;
②铜原子是29号,根据构造原理写出核外电子排布;
③Ac-表示醋酸根,配合物中配体都是分子,不带电,根据化合价代数和为零得出铜的化合价;
④根据中心原子的价层电子对数,确定杂化类型;两个原子间有且只有一条σ键;
⑤由均摊法计算氧化亚铜晶胞中Cu和O的数目,根据密度计算公式ρ=m/V计算即可.
解答 解:(I) ①A.碳正离子(CH3+)含有3个σ键,没有孤电子对,碳原子杂化方式是sp2,为平面三角形结构,键角为120°,故A正确;
B.碳负离子(CH3-)含有3个σ键,1对孤电子对,碳原子杂化方式是sp3,为三角锥形结构,键角为不是120°,故B错误;
C.甲基(-CH3)含有3个σ键,1个孤电子,碳原子杂化方式是sp3,为三角锥形结构,键角为不是120°,故C错误;
D.碳烯(:CH2)含有2个σ键,1对孤电子对,碳原子杂化方式是sp2,为平面三角形结构,由于孤电子对斥力大,键角为不是120°,故D错误;
故答案为:A;
②碳负离子(CH3-)含有3个σ键,1对孤电子对,碳原子杂化方式是sp3,为三角锥形结构;CH3-原子个数为4、价电子数为8,则与CH3-互为等电子体的一种分子是NH3,故答案为:三角锥形;NH3;
(II )①同周期从左到右电负性越来越大,所以C、N、O的电负性由大到小的顺序为O>N>C,故答案为:O>N>C;
②铜原子是29号,根据构造原理写出核外电子排布为1s22s22p63s23p63d104 s1或[Ar]3d104 s1,故答案为:1s22s22p63s23p63d104 s1或[Ar]3d104 s1;
③Ac-表示醋酸根,配合物中配体都是分子,不带电,所以铜的化合价为+1价,故答案为:+1;
④中心原子为碳,结合了1个氧原子,2个氮原子,且C无孤对电子,所以价层电子对为3对,故杂化轨道为sp2;每个碳的σ键为3条,每个亚氨基中σ键的数目2,一分子尿素中含σ键的数目为3+2×2=7,故每摩尔尿素中含有σ键的数目为7NA,故答案为:sp2;7NA;
⑤O原子在晶胞的顶点和体心,故O原子数=8×$\frac{1}{8}$+1=2,Cu原子全部在体心,故Cu原子数=4,即一个氧化亚铜晶胞中有2个O原子和4个Cu原子,即2个Cu2O,则该氧化物的密度ρ=$\frac{m}{V}$=$\frac{144×2}{{N}_{A}×(a×1{0}^{-10})^{3}}$=$\frac{288×1{0}^{30}}{{N}_{A}•{a}^{3}}$,故答案为:$\frac{288×1{0}^{30}}{{N}_{A}•{a}^{3}}$.
点评 本题考查较为全面,涉及电子排布式、分子空间构型、杂化类型的判断以及有关晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式,如何判断分子空间构型以及有关晶体计算等方法,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | Al4C3晶体,熔点2200℃,熔融态不导电 | |
| B. | C3N4晶体具有比金刚石还大的硬度 | |
| C. | VF5晶体易溶于一些有机溶剂中 | |
| D. | BaCl2熔融状态下能够导电 |
| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 050 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.60 |
(1)在实验1,反应在10至20分钟时间内平均速率为0.013mol/(L•min).
(2)在实验2,A的初始浓度c2=1.0mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是催化剂.
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3>v1(填>、=、<),且c3=>1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是反应吸热(选填吸热、放热).理由是由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动.
| A. | CH4和H3O+ | B. | NO3- 和SO3 | C. | O3和CO2 | D. | N2和C22- |
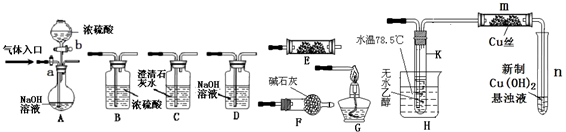
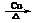 2CH3CHO+2H2O
2CH3CHO+2H2O
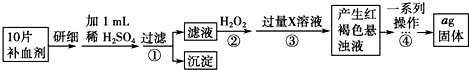


 ;
; ;
; ;
; ;
; ;
; ;
;