题目内容
13. 苯乙烯(
苯乙烯(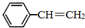 )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$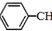 =CH2(g)+H2(g)△=+QkJ.mol-1
=CH2(g)+H2(g)△=+QkJ.mol-1(1)已知
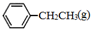 、
、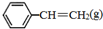 、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.
、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.(2)500℃时,在恒容密闭容器中,充入a mol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a<b(填“>”、“<”或“=”),乙苯的转化率将减小(填“增大”、“减小”或“不变”).
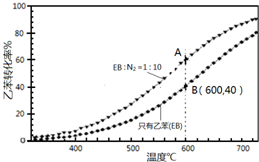
(3)在实际生产中,常保持总压0.1Mpa不变,并向反应体系加入稀释剂,如CO2、N2等.反应混合气物质的量之比及反应温度与乙苯(EB)脱氢转化率关系(N2不参与反应)如图所示.
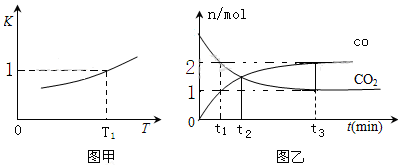
①由图判断Q>0(填“>”或“<”).
②A、B两点对应的正反应速率较大的是B.
③A点乙苯的转化率比B点高,原因是保持总压不变,充入N2,容器体积增大,各组分的浓度同倍数减小,利于反应正向进行,乙苯转化率增大.
④用平衡分压代替平衡浓度计算,其中,分压=总压×物质的量分数.则600℃时的平衡常数Kp=0.019MPa.(保留两位小数)
分析 (1)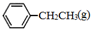 、
、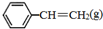 、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,则
、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,则
①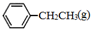 +$\frac{21}{2}$O2(g)→8CO2(g)+5H2O(l)△H=-Q1 kJ•mol-1,
+$\frac{21}{2}$O2(g)→8CO2(g)+5H2O(l)△H=-Q1 kJ•mol-1,
②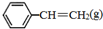 +10O2(g)→8CO2(g)+4H2O(l)△H=-Q2 kJ•mol-1,
+10O2(g)→8CO2(g)+4H2O(l)△H=-Q2 kJ•mol-1,
③H2(g)+$\frac{1}{2}$O2(g)→2H2O(l)△H=-Q3 kJ•mol-1,
由盖斯定律可知,①-②-③得到 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ =CH2(g)+H2(g);
=CH2(g)+H2(g);
(2)恒容密闭容器中,物质的量与压强成正比,增大压强平衡逆向移动;
(3)①由图可知,温度越高转化率越大;
②A、B温度相同,乙苯的浓度越大,反应速率越快;
③A点乙苯的转化率比B点高,与充入N2,容器体积增大,平衡正向移动有关;
④ CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)
=CH2(g)+H2(g)
开始 a 0 0
转化 0.4a 0.4a 0.4a
平衡 0.6a 0.4a 0.4a
分压=总压×物质的量分数,则分压分别为0.1Mpa×$\frac{3}{7}$、0.1Mpa×$\frac{2}{7}$、0.1Mpa×$\frac{2}{7}$
Kp=$\frac{0.1Mpa×\frac{2}{7}×0.1Mpa×\frac{2}{7}}{0.1Mpa×\frac{3}{7}}$,以此来解答.
解答 解:(1)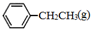 、
、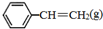 、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,则
、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,则
①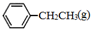 +$\frac{21}{2}$O2(g)→8CO2(g)+5H2O(l)△H=-Q1 kJ•mol-1,
+$\frac{21}{2}$O2(g)→8CO2(g)+5H2O(l)△H=-Q1 kJ•mol-1,
②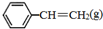 +10O2(g)→8CO2(g)+4H2O(l)△H=-Q2 kJ•mol-1,
+10O2(g)→8CO2(g)+4H2O(l)△H=-Q2 kJ•mol-1,
③H2(g)+$\frac{1}{2}$O2(g)→2H2O(l)△H=-Q3 kJ•mol-1,
由盖斯定律可知,①-②-③得到 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ =CH2(g)+H2(g);
=CH2(g)+H2(g);
则(-Q1 kJ•mol-1)-(-Q2 kJ•mol-1)-(-Q3 kJ•mol-1)=+Q kJ•mol-1,即Q=Q2+Q3-Q1,
故答案为:Q2+Q3-Q1;
(2)恒容密闭容器中,物质的量与压强成正比,充入a mol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a<b;增大压强平衡逆向移动,乙苯的转化率将减小;
故答案为:<;减小;
(3)①由图可知,温度越高转化率越大,则升高温度,平衡正向移动,Q>0,故答案为:>;
②A、B温度相同,B点乙苯的浓度大,则B点反应速率大,故答案为:B;
③A点乙苯的转化率比B点高,原因是保持总压不变,充入N2,容器体积增大,各组分的浓度同倍数减小,利于反应正向进行,乙苯转化率增大,
故答案为:保持总压不变,充入N2,容器体积增大,各组分的浓度同倍数减小,利于反应正向进行,乙苯转化率增大;
④ CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)
=CH2(g)+H2(g)
开始 a 0 0
转化 0.4a 0.4a 0.4a
平衡 0.6a 0.4a 0.4a
分压=总压×物质的量分数,则分压分别为0.1Mpa×$\frac{3}{7}$、0.1Mpa×$\frac{2}{7}$、0.1Mpa×$\frac{2}{7}$
Kp=$\frac{0.1Mpa×\frac{2}{7}×0.1Mpa×\frac{2}{7}}{0.1Mpa×\frac{3}{7}}$=0.019MPa,
故答案为:0.019MPa.
点评 本题考查化学平衡计算及平衡移动,为高频考点,把握Kp的计算、化学平衡移动的影响为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

| A. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| B. | 活化分子间的碰撞一定能导致化学键断裂 | |
| C. | 在FeCl3+3KSCN═Fe(SCN)3+3KCl平衡体系中,加入KCl固体,平衡逆向移动 | |
| D. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自发进行,原因是体系有自发地向熵增的方向转变的倾向 |
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期、第ⅦA族.
(2)表中元素原子半径最大的是(填元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,Q与水反应的化学方程式为Mg2C3+4H2O=2Mg(OH)2+C3H4↑.
(5)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,
联氨分子的电子式为①
 ,其中氮的化合价为②-2,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③NaClO+2NH3=N2H4+NaCl+H2O .
,其中氮的化合价为②-2,实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为③NaClO+2NH3=N2H4+NaCl+H2O . | A. | 喝大量冷开水 | B. | 喝大量食盐水 | ||
| C. | 喝大量牛奶 | D. | 注射大量葡萄糖水 |
| A. | CO2 | B. | NH3 | C. | H2O | D. | SO2 |
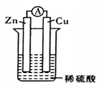
| A. | 溶液中的阳离子向正极移动,阴离子向负极移动 | |
| B. | 经过一段时问工作后'电解液的pH值减小 | |
| C. | 锌片是正极,铜片上有气泡产生 | |
| D. | 电流方向是从锌片流向铜片 |