题目内容
3.在用Zn片、Cu片和稀硫酸组成的电池装置中,下列说法中正确的是( )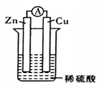
| A. | 溶液中的阳离子向正极移动,阴离子向负极移动 | |
| B. | 经过一段时问工作后'电解液的pH值减小 | |
| C. | 锌片是正极,铜片上有气泡产生 | |
| D. | 电流方向是从锌片流向铜片 |
分析 在Zn片、Cu片和稀硫酸组成的电池装置中,Zn活泼作负极,电流由正极流向负极,阴离子向负极移动,氢离子参加反应生成氢气,则氢离子减少,溶液的pH增大,以此来分析.
解答 解:A.溶液中的阳离子向正极移动,阴离子向负极移动,故A正确;
B.因氢离子参加反应生成氢气,氢离子减少,则电解液的pH增大,故B错误;
C.在Zn片、Cu片和稀硫酸组成的电池装置中,Zn活泼作负极,铜片上有气泡产生,故C错误;
D.电流方向是从Cu片经导线流向Zn片,故D错误;
故选A.
点评 本题考查原电池知识,为高考常见题型,侧重于学生的分析能力的考查,注意把握原电池工作原理,把握电极方程式的书写,注意正负极的判断、电流的方向、离子的移动方向,难度不大.

练习册系列答案
相关题目
14.下列各组离子一定能大量共存的是( )
| A. | 在无色溶液中:NH4+、Fe2+、SO42-、CO32- | |
| B. | 在含大量Ba2+溶液中:NH4+、Na+、Cl-、CO32- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 在酸性的溶液中:K+、Fe2+、Cl-、CH3COO- |
11.下列有关叙述正确的是( )
| A. | 溶于水后能电离出H+的化合物都是酸 | |
| B. | BaSO4不溶于水,故BaSO4不是电解质 | |
| C. | CO2溶于水后溶液能导电,故CO2是电解质 | |
| D. | 尽管NaCl固体不导电,但NaCl是电解质 |
18.下列反应类型:①酯化、②取代、③消去、④加成、⑤水解、⑥还原,可能在有机物分子中引入羟基的是( )
| A. | ①②③⑥ | B. | ②④⑤⑥ | C. | ②④⑥ | D. | ②③④ |
8.下列有机物命名正确的是( )
| A. | CH3CH(CH3)CH2CH3 2-甲基丁烷 | B. | 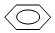 间二甲苯 间二甲苯 | ||
| C. | CH3CH2CH2CH2OH 1-羟基丁烷 | D. | 2-甲基-2-丙烯 |
15.某有机物其结构简式为 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 在加热和催化剂作用下,最多能和5mol H2反应 | |
| C. | 能使溴水褪色 | |
| D. | 一定条件下,能和NaOH醇溶液反应 |
12.下列关于电解质的判断中,正确的观点是( )
| A. | 在熔融状态下能导电的物质 | |
| B. | 在熔融或溶解状态下能导电的物质 | |
| C. | 在溶解或熔融状态下能导电的化合物 | |
| D. | 在熔融和溶液的状态下都能导电的化合物 |
1.决定物质性质的重要因素是物质结构.请回答下列问题.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
A通常显+3价,B元素的核外电子排布式为1s22s22p63s2.
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示),已知3种离子晶体的晶格能数据如表:

则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是TiN>MgO>CaO>KCl.
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个.
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是CrO2.
(5)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |

| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个.
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是CrO2.
(5)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键.
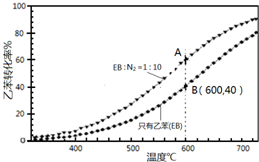 苯乙烯(
苯乙烯( )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$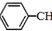 =CH2(g)+H2(g)△=+QkJ.mol-1
=CH2(g)+H2(g)△=+QkJ.mol-1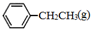 、
、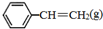 、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.
、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.