题目内容
1.在450℃,常压下,1L恒容密闭的容器中充入二氧化硫和氧气发生下列反应:2SO2(g)+O2(g)═2SO3(g)△H=-196.3KJ/mol.
如果2min内SO2的浓度由6mol/L下降为2mol/L.
请认真审题,回答下列问题:
(1)请计算出用O2的浓度变化来表示的化学反应速率为1mol/(L.min),此时间内SO2的物质的量改变了4mol.
(2)在两分钟内,以上反应放出的热量为392.6 kJ,对此反应进行加压,其它条件不变,则平衡向右(填“向左”或“不”或“向右”)移动,平衡常数不变(填“增大”或“不变”或“减小”)
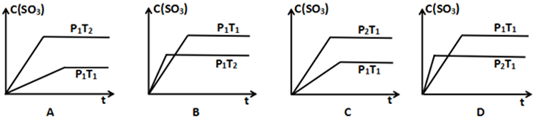
(3)已知在P1<P2,T1<T2的条件下,对于以上反应有下列平衡时间图象,纵坐标表示三氧化硫的百分含量(用“C”表示),横坐标表示反应时间,符合实际的两个选项是BC
(4)此反应是工业上制硫酸的中间过程的所发生的反应,请写出生成硫酸的反应方程式SO3+H2O=H2SO4.
分析 (1)根据方程式知,2min内SO2的浓度由6mol/L下降为2mol/L,则△c(O2)=$\frac{1}{2}$△c(SO2)=$\frac{1}{2}$×(6-2)mol/L=2mol/L,v(O2)=$\frac{△c}{△t}$,△n(SO2)=△c(SO2)V;
(2)根据二氧化硫与反应热之间的关系式计算放出的热量;增大压强平衡向气体体积减小的方向移动;化学平衡常数只与温度有关;
(3)增大压强化学反应速率增大,反应到达平衡的时间缩短,平衡正向移动,三氧化硫浓度增大;升高温度化学反应速率增大,反应到达平衡的时间缩短,平衡逆向移动,三氧化硫浓度减小;
(4)三氧化硫和水反应生成硫酸.
解答 解:(1)根据方程式知,2min内SO2的浓度由6mol/L下降为2mol/L,则△c(O2)=$\frac{1}{2}$△c(SO2)=$\frac{1}{2}$×(6-2)mol/L=2mol/L,v(O2)=$\frac{△c}{△t}$=$\frac{2mol/L}{2min}$=1mol/(L.min),△n(SO2)=△c(SO2)V=4mol/L×1L=4mol,
故答案为:1mol/(L.min);4mol;
(2)根据方程式知,2mol二氧化硫完全反应放出196.3kJ热量,则4mol二氧化硫完全反应放出392.6 kJ热量;增大压强平衡向气体体积减小的方向移动,即平衡向右移动;化学平衡常数只与温度有关,温度不变化学平衡常数不变,
故答案为:392.6 kJ;向右;不变;
(3)增大压强化学反应速率增大,反应到达平衡的时间缩短,平衡正向移动,三氧化硫浓度增大;升高温度化学反应速率增大,反应到达平衡的时间缩短,平衡逆向移动,三氧化硫浓度减小,所以符合的图象为BC,
故答案为:BC;
(4)三氧化硫和水反应生成硫酸,反应方程式为SO3+H2O=H2SO4,
故答案为:SO3+H2O=H2SO4.
点评 本题考查化学平衡移动影响因素、化学平衡计算,为高频考点,侧重考查学生获取信息、利用信息、化学反应原理解答问题能力,注意:化学平衡常数只与温度有关,与反应物浓度、反应物转化率、压强都无关,题目难度不大.

| A. | ①② | B. | ③④ | C. | ②③ | D. | ②③④ |
| 方法1 | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法2 | 用水煤气(主要成分为CO、H2等)将SO2在高温下还原成单质硫 |
| 方法3 | 用Na2SO3溶液吸收SO2转化为NaHSO3,再经电解转化为H2SO4 |
A.适当增大氨水浓度 B.使燃煤烟气与氨水充分接触
C.向氨水中加入少量硫酸 D.把氨水加热至100℃
(2)方法2中主要发生了下列反应:
①2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+8.0KJ•mol-1
②2H2(g)+SO2(g)=S(g)+2H2O(g)△H=+90.4KJ•mol-1
该方法从能量转化的角度,可看作由热能转化为化学能.
(3)方法3可用甲烷燃料电池作为电源,对吸收SO2后的NaHSO3溶液进行电解实验,如图所示.回答下列问题:
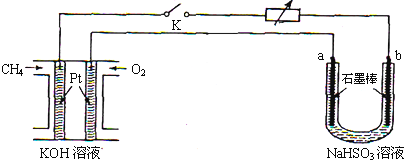
①甲烷燃料电池中,通入CH4(填“CH4”或“O2”)的一极为负极;正极的电极反应式为O2+4e-+2H2O=4OH-;该电池放电后,溶液的碱性会减弱(填“增强”,“减弱”或“不变”).
下列关于该燃料电池的说法中不正确的是B.
A.该燃料电池可把化学能直接转变为电能
B.该燃料电池中化学能100%转变为电能
C.该燃料电池的优点之一是无污染,是一种具有应用前景的绿色电源
②a电极的名称是阳极;闭合开关K后,b电极上发生的反应类型是还原反应.
③若上述甲烷燃料电池中用的是200mL 0.10mol•L-1的KOH溶液,闭合开关K一段时间后,测得U形管中生成了0.02molSO42-.试计算此时燃料电池中KOH的物质的量浓度(假设反应前后溶液的体积不变,列出计算过程).
 如表为元素周期表的一部分.
如表为元素周期表的一部分.| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期、第ⅦA族.
(2)表中元素原子半径最大的是(填元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)沸点:H2Y>H2S(填“>”或“=”或“<”),理由是H2O分子间有氢键,氢键比分子间作用力强.
(5)Y2和Y3互为同素异形体(填“同位素”或“同分异构体”或“同素异形体”).
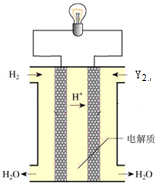
(6)其中单质Y2可用做如图所示装置(燃料电池)的氧化剂,请写出Y2在酸性电解质溶液中发生的电极反应方程式O2+4e-+4H+=2H2O.
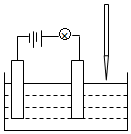 在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )| A. | 醋酸中逐滴加入氢氧化钠溶液 | B. | 硫酸钠中逐滴加入氢氧化钡溶液 | ||
| C. | 硫酸中逐滴加入氢氧化钡溶液 | D. | 盐酸中逐滴加入硝酸银溶液 |
| A. | 溶于水后能电离出H+的化合物都是酸 | |
| B. | BaSO4不溶于水,故BaSO4不是电解质 | |
| C. | CO2溶于水后溶液能导电,故CO2是电解质 | |
| D. | 尽管NaCl固体不导电,但NaCl是电解质 |
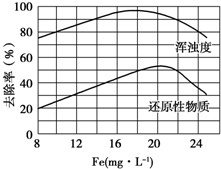 FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小.请回答下列问题:
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小.请回答下列问题: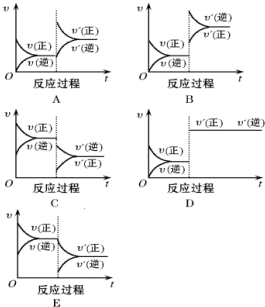
 苯乙烯(
苯乙烯(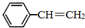 )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$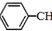 =CH2(g)+H2(g)△=+QkJ.mol-1
=CH2(g)+H2(g)△=+QkJ.mol-1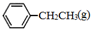 、
、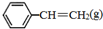 、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.
、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.