题目内容
2.下列分子的价电子模型(VSEPR模型)和分子的模型相同的是( )| A. | CO2 | B. | NH3 | C. | H2O | D. | SO2 |
分析 价层电子对互斥模型(简称VSEPR模型),根据价电子对互斥理论,价层电子对个数=σ键个数+孤电子对个数.σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;分子的模型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,略去孤电子对就是该分子的空间构型.
价层电子对个数为4,不含孤电子对,为正四面体结构;含有一个孤电子对,空间构型为三角锥形,含有两个孤电子对,空间构型是V型;
价层电子对个数为3,不含孤电子对,平面三角形结构;含有一个孤电子对,空间构型为为V形结构;
价层电子对个数是2且不含孤电子对,为直线形结构,据此判断.
解答 解:A.CO2分子中每个O原子和C原子形成两个共用电子对,价层电子对个数=σ键个数+孤电子对个数=2+$\frac{1}{2}$(4-2×2)=2,VSEPR模型为直线形结构,且不含孤电子对,所以为直线形结构,VSEPR模型与分子模型一致,故A正确;
B.NH3分子中N原子价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,VSEPR模型为正四面体结构;含有一个孤电子对,所以其空间构型为三角锥形,VSEPR模型与分子模型不一致,故B错误;
C.水分子中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,VSEPR模型为正四面体结构;含有2个孤电子对,略去孤电子对后,实际上其空间构型是V型,VSEPR模型与分子模型不一致,故C错误;
D.二氧化硫分子中氧原子价层电子对个数=2+$\frac{1}{2}$×(6-2×2)=3,VSEPR模型为平面三角形结构,含有一个孤电子对,空间构型为为V形结构,VSEPR模型与分子模型不一致,故D错误;
故选A.
点评 本题考查了价层电子对互斥模型和微粒的空间构型的关系,根据价层电子对互斥理论来分析解答,注意孤电子对个数的计算方法,为易错点,注意实际空间构型要去掉孤电子对为解答关键,题目难度中等.

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案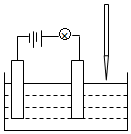 在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )| A. | 醋酸中逐滴加入氢氧化钠溶液 | B. | 硫酸钠中逐滴加入氢氧化钡溶液 | ||
| C. | 硫酸中逐滴加入氢氧化钡溶液 | D. | 盐酸中逐滴加入硝酸银溶液 |
①氧化剂是H3AsO3 ②还原性:Cl->As ③M为OH- ④SnCl62-是氧化产物
⑤每生成7.5g As(As的相对原子质量为75),还原剂失去的电子为0.3mol.
| A. | ①④⑤ | B. | ①③⑤ | C. | ①②③ | D. | ①②③④⑤ |
| A. | 为了节约应将实验过程中取用的剩余药品放回原试剂瓶 | |
| B. | 在汽油罐上所贴的危险化学品标志内容是:遇湿易燃物品 | |
| C. | 酒精着火,迅速用湿抹布或沙子盖灭 | |
| D. | 氢氧化钠溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗 |
| A. | 在无色溶液中:NH4+、Fe2+、SO42-、CO32- | |
| B. | 在含大量Ba2+溶液中:NH4+、Na+、Cl-、CO32- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、SO32- | |
| D. | 在酸性的溶液中:K+、Fe2+、Cl-、CH3COO- |
| A. | 溶于水后能电离出H+的化合物都是酸 | |
| B. | BaSO4不溶于水,故BaSO4不是电解质 | |
| C. | CO2溶于水后溶液能导电,故CO2是电解质 | |
| D. | 尽管NaCl固体不导电,但NaCl是电解质 |
| A. | 在熔融状态下能导电的物质 | |
| B. | 在熔融或溶解状态下能导电的物质 | |
| C. | 在溶解或熔融状态下能导电的化合物 | |
| D. | 在熔融和溶液的状态下都能导电的化合物 |
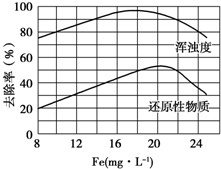 FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小.请回答下列问题:
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小.请回答下列问题: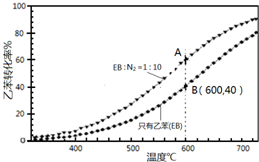 苯乙烯(
苯乙烯(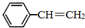 )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$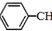 =CH2(g)+H2(g)△=+QkJ.mol-1
=CH2(g)+H2(g)△=+QkJ.mol-1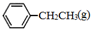 、
、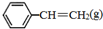 、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.
、H2(g)的燃烧热(△H)分别为-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,写出Q与Q1、Q2、Q3的关系式Q2+Q3-Q1.