题目内容
 (1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题:
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题:①用O2表示的反应的平均速率为
②平衡时SO2的转化率
(2)已知某可逆反应mA(g)+nB(g)?qC(g)在密闭容器中进行.
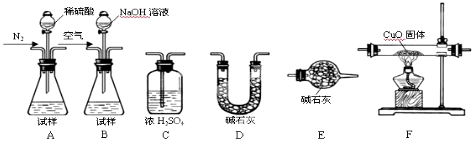
如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空
①化学计量数的关系:m+n
②该反应的正反应为
(3)在FeCl3+3KSCN?Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡
②在溶液中加入少量的KCl固体,平衡
考点:化学平衡的影响因素
专题:化学平衡专题
分析:(1)①根据浓度变化量之比等于化学计量数之比求出O2的浓度变化量,O2的平衡浓度等于O2的起始浓度减去O2的浓度变化量;
②根据平衡时容器中SO3的浓度求出参加反应的SO2的物质的量,再根据转化率的定义计算;
(2)根据“先拐先平,数值大”原则,采取定一议二得到温度和压强的大小关系,根据图示,结合压强和B的含量的关系判断方程式前后的系数和大小关系,根据温度和B的含量的关系,确定化学反应的吸放热情况;
(3)根据平衡移动原理分析,改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动;
①加入少量KSCN固体,反应中SCN-浓度增大;
②根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变.
②根据平衡时容器中SO3的浓度求出参加反应的SO2的物质的量,再根据转化率的定义计算;
(2)根据“先拐先平,数值大”原则,采取定一议二得到温度和压强的大小关系,根据图示,结合压强和B的含量的关系判断方程式前后的系数和大小关系,根据温度和B的含量的关系,确定化学反应的吸放热情况;
(3)根据平衡移动原理分析,改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动;
①加入少量KSCN固体,反应中SCN-浓度增大;
②根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变.
解答:
解:(1)①10秒后内,以SO3表示速率为v(SO3)=
=0.06mol/(L?s),
速率之比等于化学计量数之比,所以v(O2)=
v(SO3)=0.03mol/(L?s),
故答案为:0.03mol/(L?s);
②生成的SO3的物质的量为n(SO3)=2L×0.6mol/L=1.2mol,
所以参加反应的SO2的物质的量为n(SO2)=n(SO3)=1.2mol.
SO2的转化率为
×100%=30%
故答案为:30%;
(2)定压强相同,比较温度不同时,即比较曲线T1、P2与曲线T2、P2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的温度高,所以T1>T2,定温度相同,比较压强不同时,即比较曲线T1、P1与曲线T1、P2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的压强高,所以P1<P2,
①压强P1<P2,由图知压强越大,B的含量越高,所以平衡向逆反应进行,增大压强,平衡向体积减小的方向移动,所以m+n<q,故答案为:<;
②温度T1>T2,由图知温度越高,B的含量越低,所以平衡向正反应进行,升高温度,平衡向吸热方向移动,故正反应为吸热反应,故答案为:吸热;
(3)①加入少量KSCN固体,反应中SCN-浓度增大,平衡向正向移动;
故答案为:正向;
②加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,K+和Cl-不参加反应,平衡不移动;
故答案为:不.
| 0.6mol/L |
| 10s |
速率之比等于化学计量数之比,所以v(O2)=
| 1 |
| 2 |
故答案为:0.03mol/(L?s);
②生成的SO3的物质的量为n(SO3)=2L×0.6mol/L=1.2mol,
所以参加反应的SO2的物质的量为n(SO2)=n(SO3)=1.2mol.
SO2的转化率为
| 1.2mol |
| 4mol |
故答案为:30%;
(2)定压强相同,比较温度不同时,即比较曲线T1、P2与曲线T2、P2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的温度高,所以T1>T2,定温度相同,比较压强不同时,即比较曲线T1、P1与曲线T1、P2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的压强高,所以P1<P2,
①压强P1<P2,由图知压强越大,B的含量越高,所以平衡向逆反应进行,增大压强,平衡向体积减小的方向移动,所以m+n<q,故答案为:<;
②温度T1>T2,由图知温度越高,B的含量越低,所以平衡向正反应进行,升高温度,平衡向吸热方向移动,故正反应为吸热反应,故答案为:吸热;
(3)①加入少量KSCN固体,反应中SCN-浓度增大,平衡向正向移动;
故答案为:正向;
②加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,K+和Cl-不参加反应,平衡不移动;
故答案为:不.
点评:本题考查化学反应速率和化学平衡的计算,以及学生对平衡移动原理的理解,比较基础,注意(3)②中根据实际参加反应的离子浓度分析.

练习册系列答案
相关题目
下列有关的计算分析不正确的是( )
| A、在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,当有1 mol铜被氧化时,被还原的硝酸为23 mol |
| B、某溶液100 mL,其中含硫酸0.03 mol,硝酸0.04 mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015 mol |
| C、室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系为 a=4b+3c |
| D、物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比为1:4 |
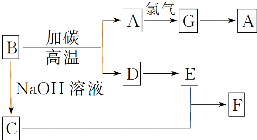 如图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的,D、E外均含有A的元素.
如图是常见物质之间的转化,其中A是芯片的主要成分,其对应的单质的结构与金刚石的结构是相似的,D、E外均含有A的元素.