题目内容
已知在硝酸溶液中,二氧化铅可氧化过氧化氢,今取二氧化铅样品(杂质不与过氧化氢反应)0.6000g于锥形瓶中,加入15.00ml稀硝酸和10ml 0.3000mol/l H2O2溶液,使试样完全溶解,然后用0.02000mol/l的酸性KMnO4溶液滴定,消耗酸性KMnO4标准溶液15.00ml,求二氧化铅的质量分数.
考点:氧化还原反应的计算
专题:
分析:根据题意,在硝酸溶液中,二氧化铅可氧化过氧化氢,发生的反应为:PbO2+H2O2+2H+═Pb2++2H2O+O2,加入15.00ml稀硝酸和10ml 0.3000mol/l H2O2溶液,使试样完全溶解,然后用0.02000mol/l的酸性KMnO4溶液滴定,消耗酸性KMnO4标准溶液15.00ml,发生的反应为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2,据此计算;
解答:
解:根据最后用0.02000mol/l的酸性KMnO4溶液滴定,消耗酸性KMnO4标准溶液15.00ml,发生的反应为:2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2,则剩余的双氧水为0.02000×15.00×10-3×
=0.75×10-3mol,所以被二氧化铅氧化的双氧水为0.3000×10×10-3-0.75×10-3=2.25×10-3mol,再根据PbO2+H2O2+2H+═Pb2++2H2O,则二氧化铅的物质的量为2.25×10-3mol,所以二氧化铅的质量分数为
=89.6%,答:二氧化铅的质量分数为89.6%;
| 5 |
| 2 |
| 2.25×10 -3×239 |
| 0.6000 |
点评:本题考查了有关氧化还原反应的计算,明确氧化还原反应的方程式是解题关键,难度不大.

练习册系列答案
相关题目
I2(g)+H2(g)?2HI(g)△H<0,在其他条件不变的情况下正确说法是( )
| A、加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B、改变压强,平衡不发生移动,反应放出的热量不变 |
| C、升高温度,反应速率加快,反应放出的热量不变 |
| D、若在原电池中进行,反应放出的热量不变 |

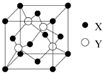 元素X位于第四周期,其基态原子的内层轨道全部排满电子,最外层电子数为2.元素Y基态原子的3p轨道有4个电子.元素Z的原子最外层电子数是内层的3倍.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,最外层电子数为2.元素Y基态原子的3p轨道有4个电子.元素Z的原子最外层电子数是内层的3倍. (1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题:
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题: