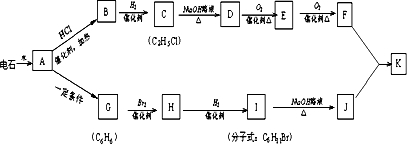
题目内容
下列有关的计算分析不正确的是( )
| A、在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,当有1 mol铜被氧化时,被还原的硝酸为23 mol |
| B、某溶液100 mL,其中含硫酸0.03 mol,硝酸0.04 mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015 mol |
| C、室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系为 a=4b+3c |
| D、物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比为1:4 |
考点:硝酸的化学性质,氧化还原反应的计算,氮的氧化物的性质及其对环境的影响
专题:
分析:A、3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,3molCu被氧化,还原的硝酸为2mol,以此计算;
B、铜与硝酸的反应生成的硝酸盐,如果有酸存在时,NO3-和H+仍是稀硝酸环境中,铜可以继续被稀硝酸氧化,稀硝酸被还原为NO气体.所以可利用Cu和H+、NO3-离子之间的反应实质来解决;
C、根据反应3NO2+H2O=2HNO3+NO,4NO+3O2+2H2O=4HNO3进行计算,注意最后剩余气体不支持燃烧,应为NO;
D、锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒规律来解决.
B、铜与硝酸的反应生成的硝酸盐,如果有酸存在时,NO3-和H+仍是稀硝酸环境中,铜可以继续被稀硝酸氧化,稀硝酸被还原为NO气体.所以可利用Cu和H+、NO3-离子之间的反应实质来解决;
C、根据反应3NO2+H2O=2HNO3+NO,4NO+3O2+2H2O=4HNO3进行计算,注意最后剩余气体不支持燃烧,应为NO;
D、锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒规律来解决.
解答:
解:A、3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,生成Cu(NO3)2体现酸的酸性,由电子守恒及原子守恒可知,3molCu被氧化,还原的硝酸为2mol,则有1mol铜被氧化时,被还原的硝酸为
mol,故A错误;
B、铜与稀硝酸反应的实质是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,在溶液中每3molCu与8molH+完全反应生成2molNO气体,题中混合溶液中含H+物质的量为:0.03mol硫酸中含0.06mol,0.04mol硝酸中含0.04mol,所以溶液中共含0.10molH+,1.92g铜的物质的量为1.92g/64g?mol-1=0.03mol,根据离子方程式量的关系,3Cu2+~8H+~2NO,氢离子过量,铜离子完全反应,生成的NO气体由铜的物质的量计算得出,气体物质的量为0.02mol,故B错误;
C、根据反应3NO2+H2O=2HNO3+NO,a mL NO2会生成
mL NO,通入O2后,
最后气体不支持燃烧,故cL为NO,即与b mL O2反应的NO为(
-c)mL,
根据方程式4NO+3O2+2H2O=4HNO3即(
-c):b=4:3,
整理可得a=4b+3c,故C正确;
D、锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒,2mol锌失去4mol电子,生成2mol锌离子,由于生成硝酸锌,则其结合的硝酸根离子是4mol,则剩余的1mol的硝酸被还原为N2O就得到4mol电子,硝酸也全部反应,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是1:4,即4Zn+10HNO3(一般稀)=4Zn(NO3)2+N2O↑+5H2O,故D正确.
故选AB.
| 2 |
| 3 |
B、铜与稀硝酸反应的实质是3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,在溶液中每3molCu与8molH+完全反应生成2molNO气体,题中混合溶液中含H+物质的量为:0.03mol硫酸中含0.06mol,0.04mol硝酸中含0.04mol,所以溶液中共含0.10molH+,1.92g铜的物质的量为1.92g/64g?mol-1=0.03mol,根据离子方程式量的关系,3Cu2+~8H+~2NO,氢离子过量,铜离子完全反应,生成的NO气体由铜的物质的量计算得出,气体物质的量为0.02mol,故B错误;
C、根据反应3NO2+H2O=2HNO3+NO,a mL NO2会生成
| a |
| 3 |
最后气体不支持燃烧,故cL为NO,即与b mL O2反应的NO为(
| a |
| 3 |
根据方程式4NO+3O2+2H2O=4HNO3即(
| a |
| 3 |
整理可得a=4b+3c,故C正确;
D、锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒,2mol锌失去4mol电子,生成2mol锌离子,由于生成硝酸锌,则其结合的硝酸根离子是4mol,则剩余的1mol的硝酸被还原为N2O就得到4mol电子,硝酸也全部反应,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是1:4,即4Zn+10HNO3(一般稀)=4Zn(NO3)2+N2O↑+5H2O,故D正确.
故选AB.
点评:本题考查氮氧化物的有关计算,题目难度较大,本题注意反应的有关化学方程式,根据方程式计算.

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
下列物质的用途与其化学性质相关的是( )
| A、用氮气作食品包装袋的填充气 |
| B、用金刚石切割玻璃 |
| C、用活性炭作净水剂 |
| D、用金属铝作导线 |
 (1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题:
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题: