题目内容
有一含Fe2O3的铁样品0.776g溶于过量盐酸,反应后无Fe3+存在,将该溶液加水稀释至100mL.取10mL通入14.56mLCl2(标准状况),溶液中恰好无Fe2+存在,求样品中铁的质量分数.
考点:有关混合物反应的计算
专题:计算题
分析:含Fe203的铁样品溶于过量盐酸,反应后无Fe3+存在,溶液中溶质为FeCl2及剩余的HCl,再通入氯气,溶液中恰好无Fe2+存在,根据电子转移守恒计算溶液中n(Fe2+),设样品中Fe2O3为xmol、Fe为ymol,根据二者总质量、Fe元素守恒列方程解答,进而计算Fe的质量分数.
解答:
解:含Fe203的铁样品溶于过量盐酸,反应后无Fe3+存在,溶液中溶质为FeCl2及剩余的HCl,再通入氯气,溶液中恰好无Fe2+存在,100mL消耗氯气为14.56mL×10=145.6mL,氯气物质的量为
=0.0065mol,根据电子转移守恒n(Fe2+)=
=0.013mol,
设样品中Fe2O3为xmol、Fe为ymol,根据二者总质量、Fe元素守恒,则:
解得
则样品中Fe的质量分数为
×100%=79.38%,
答:样品中铁的质量分数为79.38%.
| 0.1456 |
| 22.4L/mol |
| 0.0065mol×2 |
| 1 |
设样品中Fe2O3为xmol、Fe为ymol,根据二者总质量、Fe元素守恒,则:
|
解得
|
则样品中Fe的质量分数为
| 0.011mol×56g/mol |
| 0.776g |
答:样品中铁的质量分数为79.38%.
点评:本题考查混合物计算,明确发生的反应是关键,侧重考查学生分析计算能力,难度中等.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4,通过如下几个实验步可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡;⑤过滤,下列操作顺序错误的是( )
| A、③②①⑤④ |
| B、③①②⑤④ |
| C、②③①⑤④ |
| D、③①⑤②④ |
将a mL NO,b mL NO2和c mL O2混合于同一试管中,将试管倒置于水中,充分反应后,试管内气体全部消失,则a:b:c不可能是( )
| A、1:1:1 |
| B、2:1:1 |
| C、3:4:7 |
| D、1:5:2 |
 (1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题:
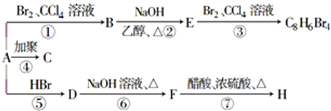
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题: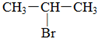 ;1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化.
;1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化.