题目内容
氮化铝是一种新型的无机非金属材料,被广泛应用于集成电路生产领域.在氮气流中由氧化铝与焦炭在电炉中加热制得.方程式为:Al2O3+N2+3C
2AlN+3CO,反应中原料配比不当或反应不完全等因素都会造成产品中含有C、Al4C3或Al2O3等杂质.请回答下列问题:
(1)探究氮化铝与酸的反应.
步骤1:取少量样品于试管中,滴加稀H2SO4溶液至样品全部溶解;
步骤2:检验生成产物中含有NH4+;写出AlN与稀H2SO4反应的化学方程式 .
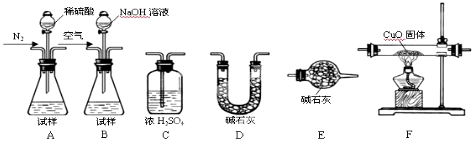
(2)测定样品中AlN的含量,请选择合适的药品和装置,按气流方向连接各装置,其顺序为: → → →E,若样品质量为16.4g,称量C增重5.1g,则AlN的质量分数是 .
(3)实验室可利用Al4C3与水反应来制备甲烷,通过排饱和食盐水的方法先后各收集半量筒甲烷和半量筒氯气,用铁架台固定好,(如图)将装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到…,量筒壁上有油状液滴生成,…,水槽中有少量固体析出.
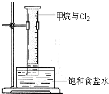
①油状液滴的成分是(写分子式) ,
②饱和食盐水中有少量固体析出,其原因是 .(请结合方程式及必要的文字解释)
| ||
(1)探究氮化铝与酸的反应.
步骤1:取少量样品于试管中,滴加稀H2SO4溶液至样品全部溶解;
步骤2:检验生成产物中含有NH4+;写出AlN与稀H2SO4反应的化学方程式
(2)测定样品中AlN的含量,请选择合适的药品和装置,按气流方向连接各装置,其顺序为:

(3)实验室可利用Al4C3与水反应来制备甲烷,通过排饱和食盐水的方法先后各收集半量筒甲烷和半量筒氯气,用铁架台固定好,(如图)将装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到…,量筒壁上有油状液滴生成,…,水槽中有少量固体析出.

①油状液滴的成分是(写分子式)
②饱和食盐水中有少量固体析出,其原因是
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)依据铵根离子的检验方法设计实验步骤进行检验,AlN是一种良好的耐热冲击材料,可溶解于硫酸溶液生成硫酸铝和硫酸铵;
(2)依据实验装置连接顺序和测定成分发生的反应分析判断,装置中的空气需要赶净,把样品溶于稀硫酸完全反应,利用氮气把生成的甲烷全部赶到F装置反应,减少误差,氮化铝水解生成氢氧化铝和氨气,氨气是碱性气体,干燥需要用碱石灰,吸收可以用浓硫酸,最后称重计算;
(3)①油状液滴的成分是甲烷和氯气光照发生取代反应生成的取代产物,液体为二氯甲烷、三氯甲烷、四氯化碳;
②饱和食盐水中氯化钠存在沉淀溶解平衡,取代反应生成的氯化氢溶于水电离出的氯离子促进人沉淀溶解平衡逆向进行,析出氯化钠晶体.
(2)依据实验装置连接顺序和测定成分发生的反应分析判断,装置中的空气需要赶净,把样品溶于稀硫酸完全反应,利用氮气把生成的甲烷全部赶到F装置反应,减少误差,氮化铝水解生成氢氧化铝和氨气,氨气是碱性气体,干燥需要用碱石灰,吸收可以用浓硫酸,最后称重计算;
(3)①油状液滴的成分是甲烷和氯气光照发生取代反应生成的取代产物,液体为二氯甲烷、三氯甲烷、四氯化碳;
②饱和食盐水中氯化钠存在沉淀溶解平衡,取代反应生成的氯化氢溶于水电离出的氯离子促进人沉淀溶解平衡逆向进行,析出氯化钠晶体.
解答:
解:(1)检验生成产物中含有NH4+,取少量样品于试管中,滴加稀H2SO4至溶液呈酸性,取反应后的溶液加入足量NaOH溶液,加热,用湿润的红色石蕊试纸检验产生的气体,若试纸变蓝,说明存在NH4+,AlN与稀H2SO4反应的化学方程式:2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4;
故答案为:2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4;
(2)为测定AlN的含量,分析AlN能够水解生成氢氧化铝和氨气,氨气是碱性气体,在装置B中加入样品滴入氢氧化钠溶液反应生成氨气,用装置D中碱石灰吸收水蒸气后,再用装置C中浓硫酸吸收氨气,称重计算,所以装置连接为B-D-C;若试样为16.4g,测得C增重5.1g为氨气的质量,样品中AlN的质量分数=
×100%=75%;
故答案为:B;D;C;75%;
(3)①油状液滴的成分是甲烷和氯气光照发生取代反应生成的取代产物,液体为二氯甲烷、三氯甲烷、四氯化碳,故答案为:CH2Cl2、CHCl3、CCl4
②饱和食盐水中氯化钠存在沉淀溶解平衡,NaCl(s)?Na+(aq)+Cl-(aq),取代反应中生成HCl溶解后电离出氯离子,使Cl-浓度增大,促使上述平衡逆向进行生成氯化钠晶体,故答案为:NaCl(s)?Na+(aq)+Cl-(aq),取代反应中生成HCl溶解后电离出氯离子,使Cl-浓度增大,促使上述平衡逆向进行生成氯化钠晶体.
故答案为:2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4;
(2)为测定AlN的含量,分析AlN能够水解生成氢氧化铝和氨气,氨气是碱性气体,在装置B中加入样品滴入氢氧化钠溶液反应生成氨气,用装置D中碱石灰吸收水蒸气后,再用装置C中浓硫酸吸收氨气,称重计算,所以装置连接为B-D-C;若试样为16.4g,测得C增重5.1g为氨气的质量,样品中AlN的质量分数=
| ||
| 16.4g |
故答案为:B;D;C;75%;
(3)①油状液滴的成分是甲烷和氯气光照发生取代反应生成的取代产物,液体为二氯甲烷、三氯甲烷、四氯化碳,故答案为:CH2Cl2、CHCl3、CCl4
②饱和食盐水中氯化钠存在沉淀溶解平衡,NaCl(s)?Na+(aq)+Cl-(aq),取代反应中生成HCl溶解后电离出氯离子,使Cl-浓度增大,促使上述平衡逆向进行生成氯化钠晶体,故答案为:NaCl(s)?Na+(aq)+Cl-(aq),取代反应中生成HCl溶解后电离出氯离子,使Cl-浓度增大,促使上述平衡逆向进行生成氯化钠晶体.
点评:本题考查了物质组成和探究方法和实验分析判断,离子检验实验步骤设计,实验步骤的理解和设计是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某温度下,反应H2(g)+I2(g)?2HI(g);△H>0.在一带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
| A、恒温,压缩体积,平衡不移动,混合气体颜色加深 |
| B、恒压,充入HI(g),开始时正反应速率减小 |
| C、恒容,升高温度,正反应速率减小 |
| D、恒容,充入H2,I2(g)的体积分数降低 |

 (1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题:
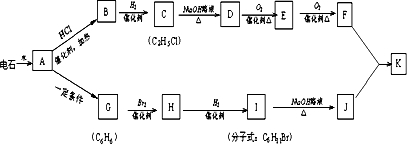
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol?L-1,请回答下列问题: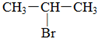 ;1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化.
;1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O.该烃A在不同条件下能发生如图所示的一系列变化.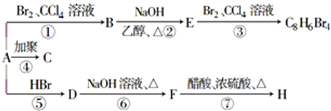
 学校实验室现有含少量NaCl杂质的Na2CO3固体样品,某化学兴趣小组的同学决定测定样品Na2CO3的质量分数,甲、乙两位同学分别设计出下列两种实验方案:
学校实验室现有含少量NaCl杂质的Na2CO3固体样品,某化学兴趣小组的同学决定测定样品Na2CO3的质量分数,甲、乙两位同学分别设计出下列两种实验方案: