题目内容
9.高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的实验步骤如图:Ⅰ、制备MnSO4溶液
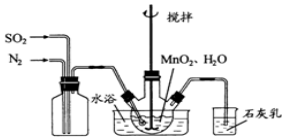
在三颈烧瓶中加入4.35gMnO2和足量的水,搅拌,通入SO2和N2,反应3h.停止通入SO2和N2,继续反应片刻,过滤,洗涤,得MnSO4溶液.
(1)制取MnSO4的化学反应方程式为MnO2+SO2=MnSO4.
(2)石灰乳的作用是吸收尾气SO2,防止污染空气.
(3)反应过程中,为使SO2尽可能转化完全,在不改变固液投料的条件下,可采取的合理措施有控制适当的水浴温度、减缓通入气体的速度、减小SO2在混合气(与N2)中的比例.(答两条)
(4)水浴加热的优点是受热均匀,容易控制温度.
Ⅱ、制备高纯MnCO3固体
已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;pH=7.7时Mn(OH)2开始沉淀.
实验步骤:
①将所得MnSO4溶液与20.0mL 2.0mol/L的Na2CO3溶液混合,充分反应;②过滤,用少量水洗涤2~3次;③用少量C2H5OH洗涤;④低温 (低于100℃) 干燥,得固体3.45g.
(1)MnSO4溶液与Na2CO3溶液混合的正确操作为a.(填序号)
a.将Na2CO3溶液缓慢滴加到MnSO4溶液中,边加边搅拌
b.将MnSO4溶液缓慢滴加到Na2CO3溶液中,边加边搅拌
c.将Na2CO3溶液迅速倒入到MnSO4溶液中,并充分搅拌
d.将MnSO4溶液迅速倒入到Na2CO3溶液中,并充分搅拌
(2)检验MnCO3固体是否洗涤干净的方法为取最后一次洗涤液少许于试管中,滴加BaCl2溶液,如果不产生沉淀,说明已洗涤干净,否则说明未洗涤干净.
(3)用少量C2H5OH洗涤的目的是乙醇沸点低于100℃,便于低温干燥且MnCO3不分解.
(4)MnCO3的产率为75%.
分析 Ⅰ.(1)由题可知,二氧化锰和二氧化硫制得MnSO4;
(2)SO2有毒,污染空气,石灰乳与SO2发生反应,吸收未反应的SO2;
(3)为使SO2尽可能转化完全,可以控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢,或者减小SO2在混合气(与N2)中的比例等;
(4)水浴加热的优点是受热均匀,容易控制温度;
Ⅱ.(1)pH=7.7时Mn(OH)2开始沉淀,故应选择将Na2CO3溶液缓慢滴加到MnSO4溶液中,边加边搅拌;
(2)MnCO3固体表面附着硫酸根离子,故检验MnCO3固体是否洗涤干净的方法为检验其洗涤液是否含有硫酸根离子即可;
(3)已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解,乙醇沸点低于100℃,便于低温干燥且MnCO3不分解;
(4)计算MnSO4溶液与20.0mL 2.0mol/L的Na2CO3溶液混合制得碳酸锰的理论量,再计算其产率.
解答 解:Ⅰ.(1)二氧化锰具有氧化性,二氧化硫具有还原性,制取MnSO4的化学反应方程式为:MnO2+SO2=MnSO4;
故答案为:MnO2+SO2=MnSO4;
(2)SO2有毒,污染空气,石灰乳与SO2发生反应,吸收未反应的SO2;
故答案为:吸收尾气SO2,防止污染空气;
(3)为使SO2尽可能转化完全,可以控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢,或者减小SO2在混合气(与N2)中的比例等;
故答案为:控制适当的水浴温度、减缓通入气体的速度、减小SO2在混合气(与N2)中的比例;
(4)水浴加热的优点是受热均匀,容易控制温度;
故答案为:受热均匀,容易控制温度;
Ⅱ.(1)pH=7.7时Mn(OH)2开始沉淀,故应选择将Na2CO3溶液缓慢滴加到MnSO4溶液中,边加边搅拌;
故答案为:a;
(2)MnCO3固体表面附着硫酸根离子,故检验MnCO3固体是否洗涤干净的方法为检验其洗涤液是否含有硫酸根离子,方法为:取最后一次洗涤液少许于试管中,滴加BaCl2溶液,如果不产生沉淀,说明已洗涤干净,否则说明未洗涤干净;
故答案为:取最后一次洗涤液少许于试管中,滴加BaCl2溶液,如果不产生沉淀,说明已洗涤干净,否则说明未洗涤干净;
(3)已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解,乙醇沸点低于100℃,便于低温干燥且MnCO3不分解;
故答案为:乙醇沸点低于100℃,便于低温干燥且MnCO3不分解;
(4)MnSO4溶液与20.0mL 2.0mol/L的Na2CO3溶液混合理论得到碳酸锰的物质的量为:20.0mL×10-3×2.0mol/L=0.04mol,质量为:0.04mol×115g/mol=4.6g,则产率为:$\frac{3.45g}{4.6g}×100%$=75%;
故答案为:75%.
点评 本题以物质制备为载体,考查学生对原理的分析理解、物质的分离提纯、氧化还原反应、物质含量测定、实验方案设计、信息获取与迁移运用等,需要学生具备扎实的基础,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案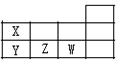
| A. | 原子半径:Y>Z>W | B. | 酸性:HWO4>HXO3>H3YO4 | ||
| C. | 热稳定性:HW>XH3>YH3 | D. | 离子半径:Y3-<Z2-<W- |
| A. | HCl的电子式 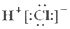 | B. | Cl-的结构示意图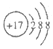 | ||
| C. | CO2的电子式 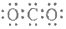 | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图1所示:
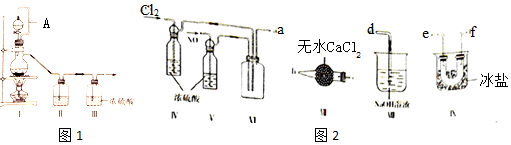
为制备纯净干燥的气体,表中缺少的药品是:
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | MnO2 | ① | ② |
| 制备纯净NO | Cu | ③ | ④ |
①装置连接顺序为a→e→f(或f→e)→c→b→d (按气流自左向右方向,用小写字母表示).
②装置 IV、V 除可进一步干燥NO、Cl2外,另一个作用是观察气泡调节气体的流速.
③装置 VII的作用是防止水蒸气进入反应器.
④装置 VIII中吸收尾气时,NOCl发生反应的化学方程式为NOCl+2NaOH=NaCl+NaNO2+H2O.
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酞氯和氯气,该反应的化学方程式为HNO3(浓)+3HC1(浓)=NOCl↑+Cl2↑+2H2O.
| A. | 过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物 | |
| B. | 某氧化物焰色反应为黄色,该氧化物为过氧化钠 | |
| C. | Na2O2中阴阳离子个数比1:l | |
| D. | 过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂 |
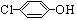 )的酸性废水;可利用微生物电池法除去,其原理如图2所示.
)的酸性废水;可利用微生物电池法除去,其原理如图2所示. -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.
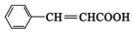 ,E中含有官能团的名称是羟基、羧基.
,E中含有官能团的名称是羟基、羧基. 或
或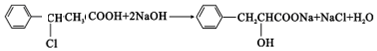 、2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
、2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.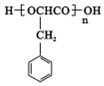 或
或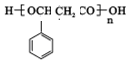 ,由E导H的反应类型为缩聚反应.
,由E导H的反应类型为缩聚反应.