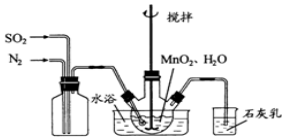
题目内容
19.X、Y、Z、W 是短周期元素,其在周期表的位置如图,请找出错误选项( )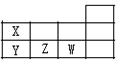
| A. | 原子半径:Y>Z>W | B. | 酸性:HWO4>HXO3>H3YO4 | ||
| C. | 热稳定性:HW>XH3>YH3 | D. | 离子半径:Y3-<Z2-<W- |
分析 由元素在周期表的位置可知,X为N,Y为P,Z为S,W为Cl,
A.同周期从左向右原子半径减小;
B.非金属性Cl>N>P,非金属性越强,对应最高价含氧酸的酸性越强;
C.非金属性越强,对应氢化物越稳定;
D.具有相同电子排布的离子中,原子序数大的离子半径小.
解答 解:由元素在周期表的位置可知,X为N,Y为P,Z为S,W为Cl,
A.同周期从左向右原子半径减小,则原子半径:Y>Z>W,故A正确;
B.非金属性Cl>N>P,酸性:HWO4>HXO3>H3YO4,故B正确;
C.非金属性越强,对应氢化物越稳定,则热稳定性:HW>XH3>YH3,故C正确;
D.具有相同电子排布的离子中,原子序数大的离子半径小,则离子半径:Y3->Z2->W-,故D错误;
故选D.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
10.四种短周期X、Y、Z、W在元素周期表中的位置如图所示.已知X、Y、Z三种元素的原子最外层电子数之和为15.下列说法正确的是( )
| X | Z | |
| Y | W |
| A. | X是第ⅢA元素,Z是第ⅤA元素 | |
| B. | 原子半径大小关系:r(Y)<r(W) | |
| C. | Y的气态氢化物比Z的气态氢化物稳定 | |
| D. | X、Y、W三种元素的最高化合价依次升高 |
14.现有两种有机化合物,不论以何种比例混合,只要物质的量之和不变,则完全燃烧时消耗氧气和生成的水的物质的量也不变.则它们可能是( )
| A. | 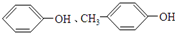 | B. | 甲苯和C3H8O3 | ||
| C. | CH4、C2H4O2 | D. | C3H4、C3H6O |
4.下列叙述中正确的是( )
| A. | 原电池的负极发生还原反应 | |
| B. | 电化学反应的实质是金属单质失去电子形成阳离子,而电子直接给氧化剂 | |
| C. | 金属在潮湿环境中主要发生析氢腐蚀 | |
| D. | 铜铁在潮湿的中性环境中锈蚀时,开始有Fe(OH)2,而后逐渐变成Fe(OH)3和Fe2O3 |
11.下列有关粒子的表示方法正确的是( )
| A. | CO2的结构式:O=C=O | B. | CH4的球棍模型: | ||
| C. | H2O的电子式: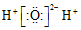 | D. | C2H4的结构简式:CH2=CH2 |
 ;
;