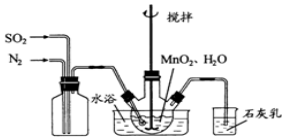
题目内容
2.下列关于过氧化钠的叙述正确的是( )| A. | 过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物 | |
| B. | 某氧化物焰色反应为黄色,该氧化物为过氧化钠 | |
| C. | Na2O2中阴阳离子个数比1:l | |
| D. | 过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂 |
分析 A.Na2O2与酸反应不仅生成盐和水,还生成O2;
B.某氧化物焰色反应为黄色,可知氧化物一定含Na元素;
C.过氧化钠中过氧根离子显-2价;
D.Na2O2与CO2反应过程中,Na2O2中氧元素化合价既升高又降低,Na2O2既是氧化剂又是还原剂.
解答 解:A.与酸反应不仅生成盐和水,还生成O2,故Na2O2不是碱性氧化物,故A错误;
B.某氧化物焰色反应为黄色,可知氧化物一定含Na元素,可能为氧化钠,故B错误;
C.过氧化钠中过氧根离子显-2价,其电子式是 ,晶体中阴阳离子个数比为1:2,故C错误;
,晶体中阴阳离子个数比为1:2,故C错误;
D.Na2O2与CO2或H2O反应过程中,Na2O2中氧元素化合价既升高又降低,Na2O2既是氧化剂又是还原剂,故D正确,
故选D.
点评 本题考查过氧化钠的性质,涉及碱性氧化物概念、焰色反应、氧化还原反应基本概念等,难度不大,侧重对基础知识的巩固.

练习册系列答案
相关题目
8.请按要求填写下列空白:
(1)写出含有10e-且呈正四面体结构的分子的名称甲烷;
(2)写出含有16e-的烃分子的电子式 ;
;
(3)写出含有18e-常温下呈液态且具有强氧化性的分子的结构式H-O-O-H.
(1)写出含有10e-且呈正四面体结构的分子的名称甲烷;
(2)写出含有16e-的烃分子的电子式
 ;
;(3)写出含有18e-常温下呈液态且具有强氧化性的分子的结构式H-O-O-H.
10.如图是进行电化学实验的两个装置,下列有关说法正确的是( )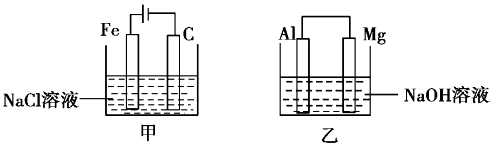

| A. | 甲装置中有沉淀生成,乙装置中Mg电极上有气泡生成 | |
| B. | 反应后,甲装置中溶液的质量增大,乙装置中溶液的质量减小 | |
| C. | 电极反应式:甲中阳极Fe-2e-=Fe2+,乙中负极Mg-2e-=Mg2+ | |
| D. | 反应后甲中溶液的pH减小,乙中溶液的pH增大 |
14.臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性.实验室可将氧气通过高压放电管来制取臭氧:3O2$\frac{\underline{\;放电\;}}{\;}$2O3.
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为35.6 g•mol-1(保留一位小数).
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为3 L.
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g.则原混合气中臭氧的体积分数为50%.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠,通过计算,分析和比较上表3组数据,给出结论.
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为35.6 g•mol-1(保留一位小数).
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为3 L.
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g.则原混合气中臭氧的体积分数为50%.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
11. 王浆酸是蜂王浆中特有的一种不饱和脂肪酸,在自然界中只有蜂王浆中才含有这种物质.其结构简式如图:下列有关干浆酸的结构与性质的说法正确的是( )
王浆酸是蜂王浆中特有的一种不饱和脂肪酸,在自然界中只有蜂王浆中才含有这种物质.其结构简式如图:下列有关干浆酸的结构与性质的说法正确的是( )
 王浆酸是蜂王浆中特有的一种不饱和脂肪酸,在自然界中只有蜂王浆中才含有这种物质.其结构简式如图:下列有关干浆酸的结构与性质的说法正确的是( )
王浆酸是蜂王浆中特有的一种不饱和脂肪酸,在自然界中只有蜂王浆中才含有这种物质.其结构简式如图:下列有关干浆酸的结构与性质的说法正确的是( )| A. | 含有两种官能团 | |
| B. | 与足里NaOH反应生成Cl0H18O3Na2 | |
| C. | 能发生加成反应,氧化反应、取代反应、加聚反应 | |
| D. | 能使Br/CCl4溶液、酸性KMnO4溶液褪色,褪色原理相同 |
12.下列反应中,属于非氧化还原反应的是( )
| A. | 3CuS+8HNO3═3Cu(NO3)2+2NO↑+3S↓+4H2O | |
| B. | Br2+2KOH═KBr+KBrO+H2O | |
| C. | 3H2O2+2KCrO2+2KOH═2K2CrO4+4H2O | |
| D. | 3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl |