题目内容
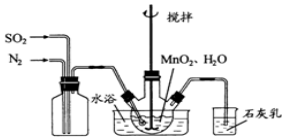
5.亚硝酞氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解.可用于合成清洁剂、触媒剂及中间体等.实验室可由氯气与一氧化氮在常温常压下合成.(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图1所示:
为制备纯净干燥的气体,表中缺少的药品是:
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | MnO2 | ① | ② |
| 制备纯净NO | Cu | ③ | ④ |
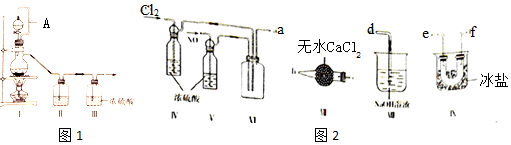
①装置连接顺序为a→e→f(或f→e)→c→b→d (按气流自左向右方向,用小写字母表示).
②装置 IV、V 除可进一步干燥NO、Cl2外,另一个作用是观察气泡调节气体的流速.
③装置 VII的作用是防止水蒸气进入反应器.
④装置 VIII中吸收尾气时,NOCl发生反应的化学方程式为NOCl+2NaOH=NaCl+NaNO2+H2O.
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酞氯和氯气,该反应的化学方程式为HNO3(浓)+3HC1(浓)=NOCl↑+Cl2↑+2H2O.
分析 由氯气与一氧化氮在常温常压下合成:由图1装置制备氯气,实验室用浓盐酸与二氧化锰制备,制得的氯气中混有氯化氢和水蒸气,故 装置Ⅱ用饱和食盐水吸收氯化氢气体,装置Ⅲ用浓硫酸干燥,由图1制备NO,用铜和稀硝酸反应制备,制得的NO中可能混有其他氮氧化合物,故 装置Ⅱ用水净化NO,装置Ⅲ用浓硫酸干燥,将氯气和NO干燥后在装置Ⅵ中发生反应,在冰盐中冷凝收集NOCl,氯气、NO以及NOCl均不能排放到空气中,用氢氧化钠溶液吸收,NOCl遇水易水解,故在收集装置和尾气处理装置之间需加一个干燥装置,据此分析解答.
解答 解:(1)图1装置制备氯气,实验室用浓盐酸与二氧化锰制备,制得的氯气中混有氯化氢和水蒸气,故 装置Ⅱ用饱和食盐水吸收氯化氢气体,
图1制备NO,用铜和稀硝酸反应制备,制得的NO中可能混有其他氮氧化合物,NO不溶于水,故 装置Ⅱ用水净化NO;
故答案为:浓盐酸; 饱和食盐水; 稀硝酸;水;
(2)①将氯气和NO干燥后在装置Ⅵ中发生反应,在冰盐中冷凝收集NOCl,氯气、NO以及NOCl均不能排放到空气中,用氢氧化钠溶液吸收,NOCl遇水易水解,故在收集装置和尾气处理装置之间需加一个干燥装置;
故答案为:e→f(或f→e)→c→b→d;
②装置 IV、V 除可进一步干燥NO、Cl2外,另一个作用是通过观察气泡调节气体的流速;
故答案为:观察气泡调节气体的流速;
③NOCl遇水易水解,故在收集装置和尾气处理装置之间需加一个装置 VII干燥装置防止水蒸气进入反应器;
故答案为:防止水蒸气进入反应器;
(3)装置 VIII中吸收尾气时,NOCl发生反应的化学方程式为:NOCl+2NaOH=NaCl+NaNO2+H2O;
故答案为:NOCl+2NaOH=NaCl+NaNO2+H2O;
(4)王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酞氯和氯气,该反应的化学方程式为:HNO3(浓)+3HC1(浓)=NOCl↑+Cl2↑+2H2O;
故答案为:HNO3(浓)+3HC1(浓)=NOCl↑+Cl2↑+2H2O.
点评 本题考查了物质制备方案设计,主要考查了化学方程式的书写、排列实验先后顺序、实验方案评价、氧化还原反应、环境保护等,题目难度中等,侧重于考查学生的分析问题和解决问题的能量.

 阅读快车系列答案
阅读快车系列答案| A. | CO2的结构式:O=C=O | B. | CH4的球棍模型: | ||
| C. | H2O的电子式: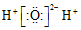 | D. | C2H4的结构简式:CH2=CH2 |
| A. | Y单质能溶于X元素的最高价氧化物的水化物 | |
| B. | W2能与H2Z发生置换反应 | |
| C. | 离子半径由大到小:Z2->X+>Y3+>W2- | |
| D. | W、X形成两种离子化合物,阴、阳离子个数比一定是1:2 |

| A. | 甲装置中有沉淀生成,乙装置中Mg电极上有气泡生成 | |
| B. | 反应后,甲装置中溶液的质量增大,乙装置中溶液的质量减小 | |
| C. | 电极反应式:甲中阳极Fe-2e-=Fe2+,乙中负极Mg-2e-=Mg2+ | |
| D. | 反应后甲中溶液的pH减小,乙中溶液的pH增大 |
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为35.6 g•mol-1(保留一位小数).
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为3 L.
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g.则原混合气中臭氧的体积分数为50%.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
| A. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ | |
| D. | 氧化镁与稀硫酸混合:MgO+2H+═Mg2++H2O |