题目内容
3.表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明.请根据此表,结合化学和生物学科的知识,回答下列问题.配料表精制海盐、碘酸钾
含碘量 20~40mg/kg
卫生许可证号××卫碘字(1999)第001号
分装日期见封底
储藏方法密封、避光、防潮
食用方法烹调时,待食品熟后加入碘盐
(1)要在食盐中加碘,是因为碘是人体必需的微量元素之一.碘在人体内的含量仅约为30mg,其中一半左右集中在甲状腺,其余则分布于其他组织.
(2)食盐中加碘,这碘指的是元素(填“单质”、“化合物”或“元素”),其中碘元素的化合价为+5.
(3)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易分解.
(4)从碘水中提取碘可采用萃取的实验方法.
分析 食盐中的碘是以碘酸钾形式存在,计算含碘量是以碘元素进行计算,人体缺碘,易导致甲状腺疾病,根据化合价代数和为0判断元素的化合价,由题中信息可知,碘酸钾易分解,碘单质在四氯化碳的溶解度比在水中的溶解度大的多,从碘水中提取碘单质用萃取操作.
解答 解:(1)人体缺碘,易导致甲状腺疾病,碘是人体内合成甲状腺激素的主要原料,
故答案为:甲状腺;
(2)食盐中的碘是以碘酸钾形式存在,计算含碘量是以碘元素进行计算,碘盐中不存在碘原子和分子,在KIO3中,K的化合价为+1价,O的化合价为-2价,根据化合价代数和为0可知I的化合价为+5价,
故答案为:元素;+5;
(3)烹调时,待食品熟后加入碘盐,说明碘酸钾不稳定,在加热时易分解,
故答案为:分解;
(4)碘单质在四氯化碳的溶解度比在水中的溶解度大的多,可用萃取提取,
故答案为:萃取.
点评 本题考查碘盐知识,题目难度不大,注意把握题给信息,并在学习中注意相关基础知识的积累.

练习册系列答案
相关题目
14.臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性.实验室可将氧气通过高压放电管来制取臭氧:3O2$\frac{\underline{\;放电\;}}{\;}$2O3.
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为35.6 g•mol-1(保留一位小数).
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为3 L.
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g.则原混合气中臭氧的体积分数为50%.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠,通过计算,分析和比较上表3组数据,给出结论.
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为35.6 g•mol-1(保留一位小数).
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为3 L.
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g.则原混合气中臭氧的体积分数为50%.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
11. 王浆酸是蜂王浆中特有的一种不饱和脂肪酸,在自然界中只有蜂王浆中才含有这种物质.其结构简式如图:下列有关干浆酸的结构与性质的说法正确的是( )
王浆酸是蜂王浆中特有的一种不饱和脂肪酸,在自然界中只有蜂王浆中才含有这种物质.其结构简式如图:下列有关干浆酸的结构与性质的说法正确的是( )
 王浆酸是蜂王浆中特有的一种不饱和脂肪酸,在自然界中只有蜂王浆中才含有这种物质.其结构简式如图:下列有关干浆酸的结构与性质的说法正确的是( )
王浆酸是蜂王浆中特有的一种不饱和脂肪酸,在自然界中只有蜂王浆中才含有这种物质.其结构简式如图:下列有关干浆酸的结构与性质的说法正确的是( )| A. | 含有两种官能团 | |
| B. | 与足里NaOH反应生成Cl0H18O3Na2 | |
| C. | 能发生加成反应,氧化反应、取代反应、加聚反应 | |
| D. | 能使Br/CCl4溶液、酸性KMnO4溶液褪色,褪色原理相同 |
15.下列反应的离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ | |
| D. | 氧化镁与稀硫酸混合:MgO+2H+═Mg2++H2O |
12.下列反应中,属于非氧化还原反应的是( )
| A. | 3CuS+8HNO3═3Cu(NO3)2+2NO↑+3S↓+4H2O | |
| B. | Br2+2KOH═KBr+KBrO+H2O | |
| C. | 3H2O2+2KCrO2+2KOH═2K2CrO4+4H2O | |
| D. | 3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl |
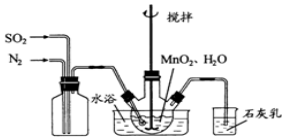
13.四氯化钛(TiCl4)是制取航天工业材料--钛合金的重要原料.实验室以TiO2和CCl4为原料制取液态TiCl4的装置如图所示(部分夹持装置省略).

已知:有关物质的性质如表:
请回答下列问题:
(1)仪器A的名称是球形干燥管,仪器A中盛装的试剂是碱石灰或生石灰、氢氧化钠,氯化钙等.
(2)CCl4的电子式为 .
.
(3)装置C处硬质玻管中反应的化学方程式为TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g).
(4)TiCl4遇潮湿空气会产生TiO2,反应的化学方程式为TiCl4+2H2O=TiO2+4HCl.
(5)仪器N中收集到的物质主要有CCl4、TiCl4(写化学式),从产物中分离出TiCl4的实验方法是蒸馏.
(6)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,生成体积比为2:1的CO和CO2混合气体,该感应中氧化剂与还原剂的物质的量之比为4:3.请设计实验方案验证产物气体中有CO:将产物气体依序通入足量的NaOH溶液→干燥剂→灼热的CuO→澄清石灰水,若最终澄清石灰水变浑浊,灼热的CuO固体由黑色变红色,则产物中有CO.

已知:有关物质的性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550℃时能被氧气氧化 |
(1)仪器A的名称是球形干燥管,仪器A中盛装的试剂是碱石灰或生石灰、氢氧化钠,氯化钙等.
(2)CCl4的电子式为
 .
.(3)装置C处硬质玻管中反应的化学方程式为TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g).
(4)TiCl4遇潮湿空气会产生TiO2,反应的化学方程式为TiCl4+2H2O=TiO2+4HCl.
(5)仪器N中收集到的物质主要有CCl4、TiCl4(写化学式),从产物中分离出TiCl4的实验方法是蒸馏.
(6)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,生成体积比为2:1的CO和CO2混合气体,该感应中氧化剂与还原剂的物质的量之比为4:3.请设计实验方案验证产物气体中有CO:将产物气体依序通入足量的NaOH溶液→干燥剂→灼热的CuO→澄清石灰水,若最终澄清石灰水变浑浊,灼热的CuO固体由黑色变红色,则产物中有CO.